时间:2019-05-30 03:30:38
1、选择题 20℃时,1LH2S的饱和溶液,浓度约为0.1mol/L.若要使该溶液的pH增大的同时c(S2-)减小,可采用的措施是( )
①加入适量的NaOH溶液
②加入适量的水
③通入适量的SO2
④加入适量硫酸铜固体
⑤加入少量盐酸.
A.①③⑤
B.②④⑤
C.②③
D.③④⑤
参考答案:①向溶液中加入氢氧化钠溶液,氢氧根离子和氢离子反应促进氢硫酸电离,硫离子浓度增大,故错误;
②加水稀释,促进氢硫酸电离,但溶液中氢离子和硫离子浓度都减小,则溶液的pH增大,故正确;
③通入适量的二氧化硫,二氧化硫和氢硫酸反应生成硫单质和水,抑制氢硫酸电离,所以溶液的PH增大,硫离子浓度减小,故正确;
④加入适量硫酸铜固体,铜离子和硫离子反应生成黑色的硫化铜沉淀,促进氢硫酸电离,氢离子浓度增大,溶液的pH减小,故错误;
⑤加入少量盐酸,氢离子浓度增大,溶液的PH减小,故错误;
故选:C.
本题解析:
本题难度:一般
2、选择题 对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是(?)
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10oC,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用盐酸中和,消耗的盐酸体积相同
参考答案:A
本题解析:同pH,同体积的弱碱和强碱,加入NH4Cl后,氢氧根均减小;温度降低Kw改变,pH改变。加水稀释十倍,氨水电离程度增加,pH(NH3·H2O)>pH(NaOH),n(NH3·H2O)>n(NaOH),NH3·H2O消耗的盐酸更多。
本题难度:一般
3、选择题 氨水中存在着下列平衡:NH3·H2O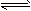 NH4++OH-,若要使平衡向逆反应方向移动,同时使OH-浓度增大,应加入的物质是
NH4++OH-,若要使平衡向逆反应方向移动,同时使OH-浓度增大,应加入的物质是
[? ]
A、NH4Cl 固体
B、硫酸
C、NaOH
D、水
参考答案:C
本题解析:
本题难度:一般
4、填空题 某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:常温下将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题: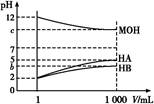
(1)HA为?酸,HB为?酸(填“强”或“弱”)。
(2)若c=9,则稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为?(用酸、碱化学式表示)。
(3)若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为c(A-)?(填“大于”、“小于”或“等于”)c(M+)。
(4)若b+c=14,则MOH为?碱(填“强”或“弱”)。将稀释后的HB溶液和MOH溶液取等体积混合,所得混合溶液的pH?7(填“大于”、“小于”或“等于”)。
参考答案:(1)强?弱? (2)MOH=HA>HB
(3)等于? (4)弱?等于
本题解析:(1)pH相同的两种酸稀释相同的倍数,弱酸的pH变化小,由图可知pH=2的酸溶液稀释1 000倍,HA的pH=5,则HA是强酸,而HB溶液稀释后pH<5,则HB是弱酸。
(2)若c=9,则MOH是强碱,则溶液中由水电离出的c(H+)=10-9 mol/L,而HA溶液pH=5,c(H+)=10-5 mol/L,则c(OH-)=c(H+)水电离=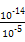 ?mol/L=10-9 mol/L,因HB溶液pH<5,则c(H+)>10-5 mol·L-1,溶液中水电离出的
?mol/L=10-9 mol/L,因HB溶液pH<5,则c(H+)>10-5 mol·L-1,溶液中水电离出的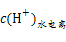 =c(OH-)<10-9 mol/L,则由水电离的c(H+)大小顺序为MOH=HA>HB。
=c(OH-)<10-9 mol/L,则由水电离的c(H+)大小顺序为MOH=HA>HB。
(3)若c=9,相当于强酸HA溶液和强碱MOH溶液等体积等浓度混合,两者恰好完全反应,则pH=7,即c(H+)=c(OH-),再根据电荷守恒可知,c(H+)+c(M+)=c(OH-)+c(A-)可得出c(A-)=c(M+)。
(4)若b+c=14,而b<5,则c>9,可判断MOH为弱碱,又因稀释前HB溶液中c(H+)=10-2 mol·L-1,稀释后HB溶液中c(H+)=10-b mol·L-1,而稀释前MOH溶液中c(OH-)=10-2 mol·L-1,稀释后MOH溶液中c(OH-)=10-14+c mol·L-1=10-b mol·L-1,故两者稀释前后,c(H+)与c(OH-)分别对应相等,据此可知:HB与MOH的强弱相当,故两溶液混合相当于等体积等浓度等电离程度的HB与MOH混合,两者恰好完全反应生成MB,且M+与B-的水解程度相同,故所得混合溶液pH=7。
本题难度:一般
5、选择题 下列物质中,属于弱电解质的是(?)
A.氨水
B.冰醋酸
C.酒精
D.硫酸钡
参考答案:B
本题解析:电解质是在水溶液中或熔化状态下能够导电的化合物。弱电解质是在水溶液中只有部分电离产生离子的电解质。A.氨水是混合物。错误。B.冰醋酸在水分子的作用下,部分发生电离:CH3COOH CH3COO-+H+。还存在着电解质分子。是弱电解质。正确。C.酒精是非电解质。D.硫酸钡尽管难溶于水,但是溶于水的完全电离,所以是强电解质。错误。
CH3COO-+H+。还存在着电解质分子。是弱电解质。正确。C.酒精是非电解质。D.硫酸钡尽管难溶于水,但是溶于水的完全电离,所以是强电解质。错误。
本题难度:一般