时间:2019-05-30 03:23:09
1、填空题 (1)已知:2SO2(g)+O2(g)?2SO3?(g)△H=-196.6kJ?mol-1;2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1 .则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=______kJ?mol-1
一定条件下,将NO2与SO2?按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______.
a.体系压强保持不
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H______0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______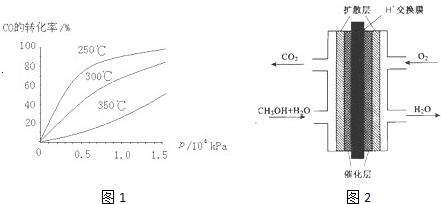
(3)甲醇(CH3OH)燃料电池的结构示意图如图2.甲醇进入______极(填“正”或“负”),正极发生的电极反应为______.
(4)101kPa时,若16gCH3OH完全燃烧生成液态水,放出热量为363.25kJ/mol,则甲醇燃烧的热化学方程式为______.
2、选择题 已知下列热化学方程式:
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.5kJ/mol
(2)2C2H6(g)+7O2(g?)═4CO2(g)+6H2O(l)△H=-3116.7kJ/mol
(3)C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H=-1409.6kJ/mol
(4)2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2596.7kJ/mol
(5)C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2217.8kJ/mol
现有由上述五种烃中的两种组合成的混合气体2mol,经充分燃烧后放出3037.6kJ热量,则下列哪些组合是不可能的( )
A.CH4和C2H2
B.C2H4和C3H8
C.C2H6和C3H8
D.C2H6和CH4
3、选择题 已知葡萄糖的燃烧热是 -2804 kJ/mol,当它氧化生成1 g 液态水时放出的热量是
A.26.0 kJ
B.51.9 kJ
C.155.8 kJ
D.467.3 kJ
4、简答题 (1)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)?2N2O5(g);若已知K350℃<K300℃,则该反应是______反应(填“吸热”或“放热”).反应达平衡后,若再通入一定量NO2,则平衡常数K将______,NO2的转化率______(填“增大”、“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
t/s
0
500
1000
c(N2O5)/mol?L-1
5.00
3.52
2.48
①写出该反应的平衡常数表达式:K=______.
②1000s内N2O5的分解速率为______.
③若每有1molN2O5分解,放出或吸收QkJ的热量,写出该分解反应的热化学方程式______.
5、填空题 (10分)工业制氢气的一个重要反应是:CO(g)+H2O(g)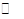 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25。C时:
①C(石墨)+1/2O2(g)=CO(g) △H1=-111kJ·mol-1
②C(石墨)+O2(g)=CO2(g) △H2=-394kJ·mol-1
③H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ·mol-1
则反应CO(g)+H2O(g) ="==" CO2(g)+H2(g)的反应热△H=___________.
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①以下反应能说明CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________
A.容器中CO的含量保持不变
B.容器中CO2浓度与CO浓度相等
C.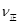 (CO)=
(CO)=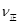 (H2O)
(H2O)
D.容器中混合气体的平均相对分子质量保持不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时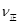 ___________
___________ (填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平衡向__________方向移动(填“正反应”、“逆反应”“不移动”)