时间:2019-05-30 03:04:42
1、选择题 下列公式中哪一个能用来精确地计算任意浓度[c(HCl)]的HCl水溶液中氢离子浓度
[c(H+)](Kw为水的离子积常数) ?(?)?
A.c(H+)="c(HCl)"
B.c(H+)=c(HCl)+Kw/c(H+)
C.c(H+)=c(HCl)+Kw
D.c(H+)=c(HCl)?Kw/c(H+)
参考答案:B
本题解析:HCl溶液中氢离子的浓度是由HCl电离产生的氢离子浓度加上水电离产生的氢离子浓度,而任何水溶液中水电离的氢离子等水电离的氢氧根,在HCl溶液中OH-都来自于水的电离,由c(H+)·c(OH-)=KW,计算出溶液中c(OH-)=Kw/c(H+)=c(H+)水
本题难度:一般
2、填空题 (1)今有①盐酸 ②醋酸的两种溶液,在体积相同,物质的量浓度均为0.1 mol/L时,H+物质的量浓度:
①_______②(填“>”、“<”或“=”,下同),pH:①_______②;中和等量NaOH时消耗的体积:
①_______②;与足量的Zn反应生成H2的物质的量:①_______②。
(2)今有①醋酸 ②硫酸的两种溶液,在体积相同、pH均为2时,溶质物质的量浓度:①_______②;分别加入足量的NaHCO3粉末,在相同条件下产生CO2的体积:①_______②;加水稀释到pH均为3时,所加水的体积:①_______②。
参考答案:(1)>;<;=;=
(2)>;>;>
本题解析:
本题难度:困难
3、选择题 体积相同、pH值相同的HCl溶液和CH3COOH溶液,与NaOH溶液完全反应时两者消耗NaOH的物质的量
A.中和HCI的多
B.中和CH3COOH的多
C.相同
D.无法比较
参考答案:B
本题解析:本题考查强弱电解质的比较,抓住强电解质溶于水全部电离,弱电解质溶于水部分电离进行相关分析。HCl为强电解质,溶于水全部电离,CH3COOH为弱电解质,溶于水部分电离,pH值相同的HCl溶液和CH3COOH溶液,醋酸的浓度大,等体积时醋酸的物质的量大,与NaOH溶液反应时,醋酸消耗NaOH多,选B。
本题难度:简单
4、选择题 下列关于电解质溶液的叙述正确的是(? )
A.常温下,由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH B++OH-
B++OH-
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
参考答案:A
本题解析:A项,常温下,0.1 mol/L的一元碱的pH=10表明该一元碱是弱碱,在溶液中不能完全电离;根据电荷守恒,B项正确的表达式应为:c(Cl-)=c(NH4+)>c(H+)=c(OH-);C项醋酸是弱酸,消耗的NaOH较多;根据水的离子积常数可知,盐酸稀释后,OH-浓度逐渐增大。
本题难度:一般
5、选择题 下列图示与对应的叙述相符的是: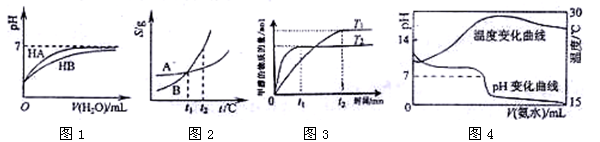
A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH。
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数 B
参考答案:
本题解析:
本题难度:困难