时间:2019-05-30 03:04:42
1、选择题
(1)在实验过程中水的电离程度的变化趋势是先_______后________;(填“增大”、“减小”或“不变”)
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。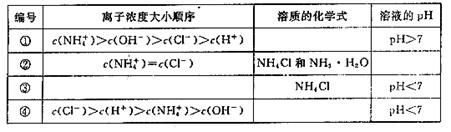
参考答案:(1) 增大?减小(2)①NH3·H2O和NH4Cl?②pH="7?" ?③c(Cl-)>c(NH4+)>c(H+)>c(OH-)?④ HCl 和 NH4Cl
本题解析:本题考查了电解质溶液中电解质的电离、水解和离子浓度问题。属于中等难度题。
 (1)由NH3·H2O? NH4Cl?HCl过量过程中,NH4+水解使水的电离程度增大,HCl过量使H+浓度增大抑制水的电离,使水的电离程度减小,所以水的电离是先增大后减小的。
(1)由NH3·H2O? NH4Cl?HCl过量过程中,NH4+水解使水的电离程度增大,HCl过量使H+浓度增大抑制水的电离,使水的电离程度减小,所以水的电离是先增大后减小的。
(2) ①中因c(NH4+)最大,所以溶质为NH3·H2O和NH4Cl;②中由电荷守恒可得溶液pH=7;③中由NH4Cl水解可得离子浓度关系;④中c(Cl-)最大,因此溶质为HCl 和 NH4Cl。
本题难度:一般
2、填空题 如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。 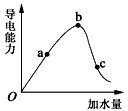
(1)O点为什么不导电 __________________。
(2)a、b、c三点的氢离子浓度由小到大的顺序为__________。
(3)a、b、c三点中,醋酸的电离程度最大的一点是__________。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E加固体CH3COONa
F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)
参考答案:
(1)因为冰醋酸未电离,无自由移动的离子
(2)c<a<b
(3)c
(4)ACEFGH
(5)BD
本题解析:
本题难度:一般
3、选择题 对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.c(H+)=c(CHCOO-)+c(OH-)
B.加入少量CH3COONa固体后,加入,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
参考答案:B
本题解析:根据电荷守恒,A正确;加入少量CH3COONa固体后,平衡虽向逆向移动,但CH3COO-不能完全抵消,c(CH3COO-)增大了,B错;由于pH=3,溶液中c(H+)=10-3mol/L,根据水的离子委积常数知,由水电离出的c(H+)是1.0×10-11 mol/L,C正确;pH醋酸+pH氢氧化钠=14,且等体积混合,反应后醋酸过量显酸性,D正确。答案选B。
本题难度:一般
4、选择题 对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是?
[? ]
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.使温度都升高20℃,两溶液的pH均不变
C.加水稀释2倍后,两溶液的pH均减小
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
参考答案:A
本题解析:
本题难度:一般
5、选择题 有四种物质:①NaHCO3、②Al(OH)3、③(NH4)2CO3、④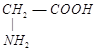 ,其中既能跟盐酸,又能跟NaOH溶液反应的有?
,其中既能跟盐酸,又能跟NaOH溶液反应的有?
A.只有②④
B.只有①②
C.只有①②③
D.①②③④
参考答案:D
本题解析:一般弱酸的酸式盐、弱酸的铵盐、两性混合物、金属铝、氨基酸等既能和盐酸反应,也能和氢氧化钠溶液反应,答案选D。
本题难度:简单