时间:2019-05-30 02:53:25
1、选择题 在0.1 mol·L-1 NH3·H2O溶液中有如下电离平衡:NH3·H2O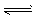 NH4++OH- 下列叙述正确的是
NH4++OH- 下列叙述正确的是
[? ]
A.加入少量浓盐酸,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量NH4Cl固体,溶液中c(OH-)减小
D.加入少量MgCl2固体,溶液c(OH-)增大
参考答案:C
本题解析:
本题难度:一般
2、选择题 关于强弱电解质的叙述正确的是:(?)
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.弱电解质的水溶液的导电能力比强电解质溶液弱
D.强电解质的稀溶液中无溶质分子,弱电解质的溶液中存在溶质分子
参考答案:D
本题解析:A.强电解质不一定是离子化合物,如盐酸是共价化合物,但它在水溶液中能完全电离,它是强电解质,弱电解质也不一定是共价化合物,如氢氧化铝是弱电解质,但它是离子化合物.A错误;B.强弱电解质和溶于水的电解质是否完全电离有关,与是否难易溶于水无关.硫酸钡难溶于水,但它是强电解质,乙酸易溶于水,但它是弱酸.故B错误;C.溶液导电能力取决于溶液中离子浓度的大小,与电解质强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强,C错误;D.强电解质在水中没有达到饱和前全电离,所以强电解质的稀溶液中无溶质分子,弱电解质部分电离层,弱电解质的溶液中存在溶质分子,D正确;选D。
本题难度:一般
3、选择题 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH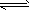 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
[? ]
A.加少量烧碱固体
B.升高温度
C.加少量冰醋酸
D.加CH3COONa
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列属于强电解质的是
A.Cu
B.CH3COONH4
C.CH3COOH
D.NH3·H2O
参考答案:B
本题解析:A、铜是单质,既不是电解质也不是非电解质,错误;B、CH3COONH4在水溶液里或熔融状态能完全电离出,所以是强电解质,正确;C、醋酸是化合物,在水溶液中是部分电离的电解质,属于弱电解质,错误;D、NH3·H2O是化合物,在水溶液中是部分电离的电解质,属于弱电解质,错误。
考点:考查强电解质和弱电解质的概念。
本题难度:一般
5、选择题 在RNH2?H2O?RNH3++OH-的平衡中,要使RNH2?H2O的电离程度及c(OH-)都增大,可采取的措施是( )
A.通入HCl
B.加少量NaOH固体
C.加水
D.升温
参考答案:A.通入HCl时,氯化氢和氢氧根离子反应生成水,所以促进RNH2?H2O的电离程度增大,但c(OH-)浓度减小,故A错误;
B.加入少量NaOH固体,溶液中c(OH-)增大,但抑制RNH2?H2O电离,故B错误;
C.加水稀释促进RNH2?H2O电离,但溶液中c(OH-)浓度减小,故C错误;
D.RNH2?H2O的电离是吸热反应,升高温度促进电离,溶液体积不变,所以氢氧根离子浓度增大,故D正确;
故选D.
本题解析:
本题难度:一般