时间:2019-05-30 02:53:25
1、填空题 (4分)工业上用MnO2为原料制取KMnO4,主要生产过程分为两步进行:第一步将MnO2和KOH、粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。电解K2MnO4的浓溶液时,两极发生的电极反应式:
阴极是??,阳极是??;
电解的总反应方程式是?。
参考答案: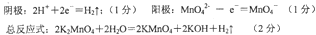
本题解析:
由题意在阳极上得到KMnO4,在阴极上得到KOH,阴极是水的电离平衡被破坏,阴极:2H2O?+2e―=H2+2OH― ;阳极:MnO42――e―=MnO42―
总反应:2K2MnO4+2H2O=2KMnO4+2KOH+H2↑
本题难度:一般
2、选择题 将已污染的空气通入某溶液,测其导电性的变化,能获得某种污染气体的含量。如把含H2S的空气通入CuSO4溶液,导电性变化不大但溶液吸收H2S的容量大;若用溴水,则吸收容量不大而导电性变化大。现要测量空气中的含氯量,并兼顾容量和导电性变化的灵敏度,最理想的吸收溶液是(?)
A.NaOH溶液?
B.蒸馏水?
C.Na2SO3溶液?
D.KI溶液)
参考答案:C
本题解析:本题错解之一是由于思维定势,对液体吸收气体容量大简单地理解为溶解度较大。常温下氯气在水中的溶解度为1∶2,属于可溶范围,符合吸收容量大的条件;再考虑氯气溶于水生成盐酸和次氯酸的导电性比蒸馏水大大增强,灵敏度也好。因此,选择了B选项。实际上气体的溶解度表示的是在1L水中溶解的气体体积数,而相同物质的量的气体和液体、固体在体积上相差一千倍左右,如1mol任何气体在标准状况下的体积为22.4L;1mol水18 mL。若1L溶液中含有1mol溶质,它吸收1mol的气体(22.4L),比溶解的气体多得多,何况溶质的物质的量大,吸收的容量将更大。错解之二是知识欠缺,只知道氯气能和NaOH溶液反应,生成氯化钠和次氯酸钠,生成物的种类增多,导电的离子浓度增大。因此,兼顾容量和导电性变化的灵敏度,实际上氯气和氢氧化钠的反应如下:Cl2+2NaOH NaCl+NaClO+H2O,2mol NaOH反应,生成1mol氯化钠和1mol次氯酸钠,离子浓度没有改变,导电能力不变。由于氯气和亚硫酸钠发生如下反应:Cl2+Na2SO3+H2O
NaCl+NaClO+H2O,2mol NaOH反应,生成1mol氯化钠和1mol次氯酸钠,离子浓度没有改变,导电能力不变。由于氯气和亚硫酸钠发生如下反应:Cl2+Na2SO3+H2O 2HCl+Na2SO4,从吸收容量上看,用亚硫酸钠溶质吸收氯气符合题意容量大的要求;从反应方程式上看:1mol亚硫酸钠转化为1mol硫酸钠和2mol盐酸,离子的浓度增大1倍(从离子所带电荷总量看),符合导电性增强。选项C为正确答案。
2HCl+Na2SO4,从吸收容量上看,用亚硫酸钠溶质吸收氯气符合题意容量大的要求;从反应方程式上看:1mol亚硫酸钠转化为1mol硫酸钠和2mol盐酸,离子的浓度增大1倍(从离子所带电荷总量看),符合导电性增强。选项C为正确答案。
本题难度:简单
3、选择题 体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01 mol,下列叙述错误的是
[? ]
A.c(HCl)<c(CH3COOH)
B.两种溶液的pH相同
C.两种溶液与NaOH完全中和时,CH3COOH所消耗的NaOH多
D.两种溶液与足量CaCO3反应时,生成的CO2一样多
参考答案:D
本题解析:
本题难度:一般
4、填空题 (6分)根据下列事实,完成相关的离子方程式或电离方程式
(1)Na2S溶液使酚酞显红色
(2)硫酸铝钾[明矾KAl(SO4)2·12H2O]可以作净水剂
(3)常温下,磷酸(H3PO4)溶液pH
参考答案:
本题解析:
本题难度:一般
5、填空题 (8分)(1)请完成下列 各空:
各空:
①pH= a的 CH3COOH溶液稀释100倍后所得
CH3COOH溶液稀释100倍后所得 溶液pH a +2(填“>”或“<”)
溶液pH a +2(填“>”或“<”)
②0.01mol/LCH3COOH溶液的pH 2(填“>”或“<”);
(2)观察比较以上两个小题,试猜想证明某酸(HA)是弱电解质的原理有两个:
一是: ;
二是:  。
。
(3)请你根据以上原 理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)
理提出一些方案,证明HA酸是弱电解质:(只需简明写出方案,不需写出具体步骤,以下项目可不填满也可增加项目)
①
②
参考答案:(8分)
(1)①<;②>;(2分)
(2)一是:溶液中存在电离平衡;(2分)
二是:证明HA不能完全电离。(2分)
(3)①对比等物质的量浓度的HA溶液和盐酸导电性对比实验;
②测0.01mol/LHA溶液的pH>2;
③测pH= a的HA稀释100倍后所得溶液pH<a +2
④中和10mLpH=1的HA溶液消耗pH=13的NaOH溶液的体积大于10mL;
以上任意两个或其他合理答案均可。(2分)
本题解析:略
本题难度:一般