时间:2019-05-30 02:45:46
1、选择题 关于如图所示的原电池,下列说法正确的是(?)
A.盐桥中的阴离子向硫酸铜溶液中迁移
B.锌电极发生还原反应,铜电极发生氧化反应
C.铜电极上发生的电极反应是2H++e— →H2↑
D.电子从锌电极通过检流计流向铜电极
参考答案:D
本题解析:考查原电池的有关判断。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,铜是正极,因此盐桥中的阴离子向硫酸锌溶液中迁移,所以选项AB都是错误的;选项C不正确,应该是溶液中的铜离子得到电子析出铜,所以正确的答案选D。
本题难度:一般
2、选择题 FeCl3可用于腐蚀覆有铜箔的绝缘胶板来制作印刷电路板,工业上常采用电解法来处理该反应后的废液。电解时,下列叙述正确的是(? )
A.阳极放出大量氯气
B.阴极放出大量氢气
C.电解液逐渐变为黄色
D.电解液逐渐变为绿色
参考答案:C
本题解析:因发生2FeCl3+Cu 2FeCl2+CuCl2导致废液中含有CuCl2、FeCl2、FeCl3等成分。电解时Cl-在阳极放电生成Cl2,生成的Cl2因氧化Fe2+而不会大量放出;Fe3+、Cu2+在阴极放电,因Fe3+的氧化性强于Cu2+, 所以Fe3+优先放电生成Fe2+,而因Cl2氧化Fe2+又变化成Fe3+,所以Cu2+难以放电。
2FeCl2+CuCl2导致废液中含有CuCl2、FeCl2、FeCl3等成分。电解时Cl-在阳极放电生成Cl2,生成的Cl2因氧化Fe2+而不会大量放出;Fe3+、Cu2+在阴极放电,因Fe3+的氧化性强于Cu2+, 所以Fe3+优先放电生成Fe2+,而因Cl2氧化Fe2+又变化成Fe3+,所以Cu2+难以放电。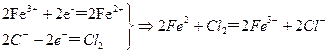
本题难度:简单
3、选择题 下列关于实验现象的描述不正确的是? (? )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
参考答案:C
本题解析:A.把铜片和铁片紧靠在一起浸入稀硫酸中,形成了原电池,由于Fe的活动性比Cu强,所以Fe作负极,Cu作正极,在正极上H+得到电子变为氢气,因此铜片表面出现气泡。正确。B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,实质是电镀。会在阴极铁片表面镀上一层锌。正确。C.把铜片插入三氯化铁溶液中,发生反应:2FeCl3+Cu==2FeCl2+ CuCl2因此在铜片会逐渐溶解。错误。D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,发生反应Zn+ CuCl2= ZnCl2+Cu,产生的Cu附着在Zn上,构成了Cu、Zn原电池,因而反应速率加快。气泡放出速率加快。正确。
本题难度:简单
4、选择题 如图为铜锌原电池示意图,下列说法不正确的是( )
A.反应物是锌和稀硫酸
B.铜片上不产生气泡
C.电流计显示导线上电子由锌片流向铜片
D.该装置能将化学能转变为电能
参考答案:A、锌、铜和稀硫酸组成的原电池,电池总反应为Zn+H2SO4=ZnSO4+H2↑,则反应物是锌和稀硫酸,故A正确;
B、铜作正极,正极上氢离子得电子发生还原反应生成氢气,所以Cu上有气泡生成,故B错误;
C、锌作负极,负极上锌失电子,所以电子从Zn沿导线流向Cu,故C正确;
D、该装置属于原电池,原电池是把化学能转化为电能的装置,故D正确;
故选B.
本题解析:
本题难度:一般
5、填空题 (10分)将洁净的金属片Fe、Zn 、A、B 分别与Cu用导线连结浸在合适的电解质溶液里。实验并记录电压指针的移动方向和电压表的读数如下表所示:
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe? → Cu | +0.78 |
| Zn | Zn? → Cu | +1.10 |
| A | Cu? → A | -0.15 |
| B | B? → Cu | +0.3 |
参考答案:(10分)(1)大?(2分)
(2)Zn> B > A?(2分)
(3)Cu(2分);Cu-2e-= Cu2+(2分)
(4)B?(2分)
本题解析:略
本题难度:简单