时间:2019-05-30 02:43:18
1、填空题 (10分)下图是一个化学过程的示意图。
(1)图中乙池是 装置。
(2)c(Pt)电极的名称是 。
(3)写出通入CH3OH的电极的电极反应式是 。
(4)乙池中反应的离子方程式为 。
(5)当乙池中B(Ag)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下);此时丙池某电极析出1.6g某金属,则丙中的某盐溶液可能是 (填序号)
A.MgSO4
B.CuSO4
C.NaCl
D.CuCl2
参考答案:(10分)
(1)电解池 (2) 阳极 (3)CH3OH+8OH--6 e- CO32-+6H2O
(4)4Ag++2H2O 4Ag+O2↑+4H+ (5)280 B、D
4Ag+O2↑+4H+ (5)280 B、D
本题解析:(1)该装置甲池是甲醇燃料电池,属于原电池,则装置乙和丙为电解池。
(2)“串联各池,阴阳交替”,d电极与原电池的负极相连,d电极为阴极,则c(Pt)电极的名称是阳极。
(3)在甲醇燃料电池中,甲醇在负极失电子,在碱性溶液中生成碳酸钾,电极反应式是CH3OH+8OH--6 e- CO32-+6H2O
(4)在乙池中,银电极作阴极,则乙池是用惰性电极电解硝酸银溶液,乙池中反应的离子方程式为4Ag++2H2O 4Ag+O2↑+4H+。
4Ag+O2↑+4H+。
(5)根据电极反应:乙池B电极:Ag++e-=Ag 甲池正极:O2+4e-+2H2O = 4OH-,根据各电极放电量相等,得关系式:4Ag—O2,5.40g银的物质的量为0.05mol,转移电子0.05mol,则消耗氧气0.0125mol,体积为0.0125×22.4×1000=280mL。丙池析出金属0.64g,丙池转移电子的物质的量也是0.05mol,则1.6/0.05=32若该金属是+1价,则该金属的相对原子质量是32×1=32,若该金属是+2价金属,则该金属的相对原子质量是32×2=64,若该金属是+3价金属,则该金属的相对原子质量是32×3=96,选B、D。
考点:考查电解池、原电池的工作原理。
本题难度:一般
2、选择题 有如表所示三个实验
| 实验1 | 将金属X与金属Y用导线连接,浸入电解质溶液中,Y不易被腐蚀 |
| 实验2 | 将片状的金属X、W分别投入等体积、等物质的量浓度的盐酸中,都有气体产生,W比X反应剧烈 |
| 实验3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
参考答案:B
本题解析:A、实验1表明X的活泼性大于Y,Y为原电池的正极;实验2表明W比X活泼;实验3表明Y比Z活泼,据此可知金属的活动性顺序:W>X>Y>Z,错误;B正确;C、如果Z位于金属活动性顺序表中Cu以后,则Z不能置换出Cu,错误;D、用X、Z和稀硫酸构成原电池时,X活泼为负极,错误,答案选B。
本题难度:一般
3、选择题 下列实验装置符合实验目的是( )
| 目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 装置     选项 A B C D |
参考答案:A.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解质溶液为可溶性的硫酸铜溶液,故A错误;
B.根据电流方向知,碳棒作阳极,铁棒作阴极,阳极上氯离子失电子生成氯气,氯气能和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,阴极上氢离子放电生成氢气,同时阴极附近生成氢氧根离子而使溶液呈碱性,无色酚酞试液遇碱变红色,所以该装置能检验氯化钠溶液的产物,故B正确;
C.电镀时,镀层铜作阳极,镀件铁作阴极,铁应该连接电源负极,电解质溶液为可溶性的铜盐,故C错误;
D.该装置要形成原电池,铁作负极、碳作正极,正极所在的电解质溶液为氯化铁溶液,负极所在溶液为氯化亚铁溶液,故D错误;
故选B.
本题解析:
本题难度:简单
4、推断题 X、Y、Z三种短周期元素,它们的原子序数之和等于16,X2、Y2、Z2在常温下都是无色气体,它们均为工业合成某化工产品的重要原料,其流程如下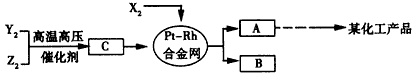
已知:
①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;
②B和C分子均为常见的10电子微粒。
请回答下列问题:
(1)X元素在周期表中的位置是________;
(2)X2与Z2可制成新型化学电源(KOH溶液作电解质溶液),两个电极均由多孔石墨制成,通入的气体在电极表面放电,负极电极反应式为________;
(3)化合物B吸收C后形成的溶液pH________7(填“大 于”、“小于”或“等于”),其原因是(用化学用语表示)_________;
(4)写出由C生成A和B的化学方程式________。
参考答案:(1)第二周期第ⅥA族
(2)H2+2OH--2e-=2H2O
(3)大于;NH3·H2O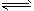 NH4++OH-(或NH3+H2O
NH4++OH-(或NH3+H2O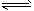 NH3·H2O
NH3·H2O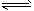 NH4++OH-)
NH4++OH-)
(4)4NH3+5O2 4NO+6H2O
4NO+6H2O
本题解析:
本题难度:一般
5、填空题 (14分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图: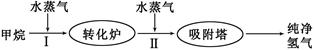
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1[来源:] |
| B | 0、0、2、2 | c2 | Q2 | α2 ? |
| C | 2、2、0、0 | c3 | Q3 | α3 |
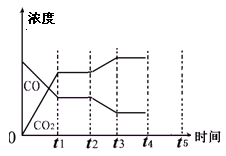
参考答案:(1)放;66.7%(2)AD (3)②③(4)降低温度,或增加水蒸汽的量,或减少氢气的量;(每格2分)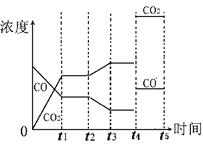
本题解析:(1)温度越高,平衡常数越小,所以正反应是放热反应。
CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
起始量(mol)? 1? 2? 0? 0
转化量(mol)? x? x? x? x
平衡量(mol)? 1-x? 2-x? x? x
根据平衡常数知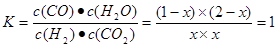
解得x=2/3,所以平衡后CO的转化率为是66.7%。
(2)因为反应前后体积,即改变压强平衡不会发生移动,根据所给的反应物投入量来看ABC就是等效的,虽然氢气的含量,但氢气的浓度不同,其中BC相等且都是A的2倍。根据500℃平衡常数可计算出A中反应物的转化率均是75%【计算方法同(1)】,即平衡时A中CO、H2O、H2、CO2分别是0.25mol、0.25mlol、0.75mol、0.75mol,则平衡时B、C中CO、H2O、H2、CO2分别都为0.5mol、0.5mol、1.5mol、1.5mol。即B、C中转化率分别是25%和75%。A中放热Q1,所以反应热是-2Q1kJ·mol-1。则C中放热2Q1,B中吸热Q1。答案AD正确。
(3)因为体系绝热,而反应是放热反应,所以压强会发生变化,①⑤可以。反应前后气体质量和容器的体积均不发生变化,所以密度不变,②不可以。反应前后气体质量和物质的量均不发生变化,所以相对分子质量不变,③不可以。④⑥符合化学平衡的概念正确。答案是②③。
(4)由图像可知t2时刻CO浓度减小,CO2浓度增大,因此改变的条件是降低温度,或增加水蒸汽的量。t4时刻通过改变容积的方法将压强增大为原先的两倍,平衡不移动,但物质的浓度均增大,都变为原来大2倍,如图所示: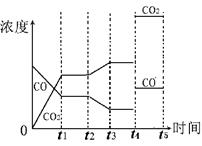
本题难度:一般