时间:2019-05-30 02:43:18
1、选择题 下列有关电池的说法不正确的是
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.铜锌原电池工作时,锌电极发生氧化反应
D.锌锰干电池中,锌电极是负极
2、填空题 (8分).设计总反应为:2Fe3++Fe==3Fe2+原电池,在框内画出图示。并写出两极反应式。
正极:_______________________负极:_______________________
3、选择题 一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH=4K2CO3+10H2O。有关此电池的推断正确的是(?)
A.负极反应为:14H2O+7O2+28e—=28OH—
B.放电一段时间后,负极周围的pH升高
C.理论上消耗1mol C2H6,电路上转移的电子为14mol
D.放电过程中,K+向负极移动
4、选择题 镁燃料电池作为一种高能化学电源,具有良好的应用前景。如图是镁-空气燃料电池工作原理示意图。下列有关该电池的说法正确的是? ( )。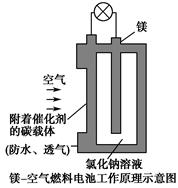
A.该电池Mg作负极,发生还原反应
B.该电池的正极反应式为O2+2H2O+4e-=4OH-
C.电池工作时,电子通过导线由碳电极流向Mg电极
D.当电路中通过0.2 mol电子时,消耗的O2体积为1.12 L
5、选择题 有关下图装置的说法中正确的是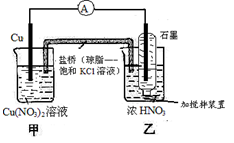
A.氧化剂与还原剂必须直接接触,才能发生反应
B.乙池中电极反应式为NO3-+4H+ + e-=NO2↑+2H2O
C.当铜棒质量减少6.4g时,甲池溶液质量增加6.4g
D.当铜棒质量减少6.4g时,向乙池密封管中通入标准状况下1.12LO2,将使气体全部溶于水