时间:2019-05-30 02:38:55
1、选择题 下列混合溶液中,各离子浓度的大小顺序的表示中,正确的是? (? )
A.10 mL 0.10 mol·L-1氨水与10 mL 0.10 mol·L-1盐酸混合
c(Cl-)> c(NH4+)> c(OH? -) > c(H+)
B.10 mL 0.10 mol·L-1 NH4Cl溶液与5 mL 0.20 mol·L-1 NaOH溶液混合
c(Na+) = c(Cl?-])> c(OH? -)> c(H+)
C.10 mL 0.10 mol·L-1 CH3COOH溶液与5 mL 0.20 mol·L-1 NaOH溶液混合
c(Na+)= c(CH3COO-) > c(OH? -) > c(H+)
D.10 mL 0.50 mol·L-1 CH3COONa溶液与6 mL 1.0 mol·L-1盐酸混合
c(Cl-) > c(Na+)> c(OH? -) > c(H+)
参考答案:B
本题解析:略
本题难度:简单
2、选择题 含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为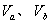 ,则两者的关系正确的是
,则两者的关系正确的是
A.Vb
参考答案:
本题解析:
本题难度:一般
3、选择题 常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。则下列各项正确的是 ( )。
A.混合前:pH(CH3COOH)+pH(NaOH)=14
B.混合后:c(Na+)=c(CH3COO-)+c(OH-)
C.混合前:c(CH3COOH)>c(NaOH)
D.混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
参考答案:C
本题解析:混合前,若pH(CH3COOH)+pH(NaOH)=14,则,c(H+)=c(OH-),CH3COOH为弱电解质,部分电离,c(CH3COOH)比c(NaOH)大得多,混合后不会呈中性而是呈酸性,故A不正确,C正确;混合后溶液呈中性,则c(H+)=c(OH-),根据电荷守恒,c(Na+)=c(CH3COO-),故B、D不正确。
本题难度:一般
4、选择题 下列有关“电离平衡”的叙述正确的是(?)
A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等
B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡
C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动
D.电解质达到电离平衡后,各种离子的浓度相等
参考答案:C
本题解析:弱电解质的电离达到平衡时,分子和离子的浓度不再变化,但不一定相等;而且是动态平衡,只不过分子电离成离子的速率与离子结合成分子的速率相等。
本题难度:一般
5、填空题 (12分)现有①0.2 mol/L NaOH溶液 ②0.2 mol/LHX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-)?②中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)上述混合液中共存在?种粒子,且c(HX)?c(X-)(填“>”、“<”或“=”,下同),c(HX)+c(X-)?0.1 mol/L(忽略体积变化)。
(3)上述混合液显?性(填“酸”、“碱”或“中”),其原因用离子方程式表示为?。
参考答案:(1) < ;? (2)? 6 ,<?, = ; (3 ) 碱 , X-+H2O  ?HX+OH-
?HX+OH-
本题解析:略
本题难度:简单