时间:2019-05-30 02:38:55
1、选择题 某温度下,体积和pH均相同的氢氧化钠溶液和氨水分别加水稀释,溶液的pH随溶液体积(V)变化的曲线如图所示,则下列判断中正确的是( )
A.I是氨水的pH变化曲线
B.b、c两点溶质的浓度相等
C.中和a点时氨水和氢氧化钠溶液所需硫酸的物质的量相等
D.c→d的变化过程中,溶液中所有离子的浓度均减小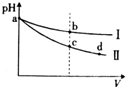
参考答案:A
本题解析:
本题难度:简单
2、填空题 (10分)已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+? ΔH>0。
CH3COO-+H+? ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=_________(填数字表达式)。
下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是____(填字母)。
a.加入少量0.10 mol·L-1的稀盐酸? b.加热
c.加水稀释至0.010 mol·L-1? d.加入少量冰醋酸
e.加入少量氯化钠固体? f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V盐酸______V醋酸 ,(填“>”、“<”或“=”下同),反应的最初速率为:υ盐酸_______υ醋酸。
(3)常温下,向体积为Va mL,pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:_____________;溶液中各离子的浓度按照由大到小排序为_______。
参考答案:(1)(10-5-10-9)mol/L ?b、c、f?(2)<?=?
(3)Va < Vb? c(Na+) = c(CH3COO-) > c(H+) = c(OH-)
本题解析:(1)在醋酸溶液中其电荷守恒为: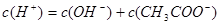 ,由于pH =5即
,由于pH =5即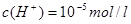 ,所以可得c(CH3COO-)=(10-5-10-9)mol/L;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是:因电离是吸热反应加热电离程度增大;稀释电离程度增大;加入少量0.10 mol·L-1的NaOH溶液能与氢离子反应使醋酸的电离程度增大;
,所以可得c(CH3COO-)=(10-5-10-9)mol/L;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是:因电离是吸热反应加热电离程度增大;稀释电离程度增大;加入少量0.10 mol·L-1的NaOH溶液能与氢离子反应使醋酸的电离程度增大;
(2)等体积且pH均等于3的醋酸和盐酸溶液中,因醋酸是弱酸,所以醋酸的物质的量更大,所以生成氢气的体积:V盐酸小于V醋酸 , 应的最初速率为:υ盐酸=υ醋酸。
(3)若两都等体积反应,则醋酸过量溶液显酸性,而现要使溶液显中性,即Va < Vb;溶液中各离子的浓度按照由大到小排序为c(Na+) = c(CH3COO-) > c(H+) = c(OH-);
本题难度:简单
3、选择题 由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7?K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2?K2=1.02×10-7 |
参考答案:B
本题解析:弱酸的电离平衡常数越大,酸性越强。根据电离平衡常数可知,酸性强弱顺序是H2SO3>HC2O3>HSO3->HCO3-,所以根据较强的酸制备减弱的酸可知,A、C、D均是正确的,B不正确,即HSO3-不能制备碳酸,答案选B。
本题难度:一般
4、填空题 回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)液氨类似于水的电离,试写出液氨的电离方程式 ;
(3)下列离子方程式书写正确的是 。
参考答案:
本题解析:
本题难度:一般
5、选择题 下列有关物质的性质或应用说法不正确的是
[? ]
A.H2CO3的酸性比H2SiO3的酸性弱
B.C60具有单质碳的性质,与金刚石是同素异形体
C.工业生产中的二氧化硫废气可以用石灰乳吸收
D.某些金属氧化物可以作为颜料
参考答案:A
本题解析:
本题难度:简单