时间:2019-03-14 22:55:05
1、填空题 常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示): 。
(2)混合溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(OH-)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是 (填序号)。
参考答案:(1)A-+H2O HA+OH-
HA+OH-
(2)>
(3)9.9×10-7 10-8
(4)> A>B>D>C
本题解析:(2)混合溶液由于A-水解,促进水的电离,而NaOH抑制水的电离。
(3)一开始c(Na+)=c(A-),但Na+不水解,A-水解,c(Na+)与c(A-)之差即为水解的A-的量。pH=8,c(H+)=10-8 mol·L-1,c(OH-)=10-6 mol·L-1。
由H2O电离的c(OH-)H2O=c(H+)=10-8 mol·L-1
A-+H2O HA+OH-
HA+OH-
则c(Na+)-c(A-)=c(OH-)-c(OH-)H2O=9.9×10-7 mol·L-1
c(OH-)-c(HA)=10-6 mol·L-1-9.9×10-7 mol·L-1=10-8 mol·L-1
(4)NH4A溶液为中性,说明NH4+与A-的水解程度相当,而HA加到Na2CO3中有气体放出,说明HA酸性强于H2CO3,CO32-水解程度大于A-,因而(NH4)2CO3溶液pH>7,NH4HCO3溶液的pH也同样大于7。Cl-和SO42-不水解,所以(NH4)2SO4和NH4Cl溶液显酸性,但(NH4)2SO4中NH4+更多,水解程度更大,因而pH[(NH4)2SO4]<pH(NH4Cl)<7=pH(NH4A)<pH(NH4HCO3)。
本题难度:一般
2、选择题 恒温条件下,在CH3COONa的稀溶液中分别加入下列的物质,能使c(CH3COO—)/c(Na+)比值一定增大的是
A.固体NaOH
B.固体KOH
C.固体NaCl
D.冰醋酸
参考答案:BD
本题解析:CH3COONa 溶液中存在:CH3COO-+H2O CH3COOH +OH-,加入固体KOH、冰醋酸均可使平衡左移,c(CH3COO-)增大,c(CH3COO—)/c(Na+)比值增大,加固体NaOH,平衡虽左移,但c(CH3COO—)/c(Na+)比值减小,加固体NaCl,不影响平衡,c(CH3COO—)/c(Na+)比值减小选BD。
CH3COOH +OH-,加入固体KOH、冰醋酸均可使平衡左移,c(CH3COO-)增大,c(CH3COO—)/c(Na+)比值增大,加固体NaOH,平衡虽左移,但c(CH3COO—)/c(Na+)比值减小,加固体NaCl,不影响平衡,c(CH3COO—)/c(Na+)比值减小选BD。
考点:考查盐的水解等知识。
本题难度:一般
3、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0molL-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1
参考答案:C
本题解析:A、pH=4的醋酸中:c(H+)=10—4mol·L-1,错误;B、根据物料守恒知,饱和小苏打溶液中:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3),错误;C、根据电荷守恒知,饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-),正确;D、50℃时Kw>1×10-14,pH=12的纯碱溶液中:c(OH-)>1.0×10-2mol?L-1,错误。
考点:考查pH计算、溶液中离子浓度大小关系。
本题难度:一般
4、填空题 工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。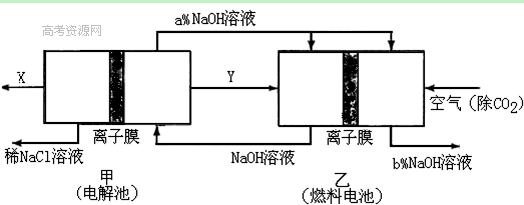
①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%
参考答案:
本题解析:
本题难度:困难
5、选择题 200mL0.1 mol·L-1CH3COOH与200mL0.1 mol·L-1NaOH溶液混合后,离子浓度关系正确的是
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+)+c(OH-)= c(CH3COO-)+c(H+)
D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:A
本题解析:试题分析:200mL0.1 mol·L-1CH3COOH与200mL0.1 mol·L-1NaOH溶液混合后,相当于400mL0.1 mol·L-1CH3COONa溶液,A、正确,物料守恒,钠元素的总量与醋酸的各种存在形态相当;B、D不正确,CH3COO―少量水解,溶液呈碱性,c(CH3COO-)>c(OH-),应为c(Na+)>c(CH3COO-)>c(OH-)>c(H+);C、不正确,由电荷守恒可知:c(Na+)+c(H+)= c(CH3COO-)+c(OH-);选A。
考点?:电解质溶液中离子浓度间关系及大小比较
本题难度:困难