时间:2019-03-14 22:37:12
1、实验题 (15分)某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取。
① Na2CO3② NaOH?③ Ca(OH)2④ NaHCO3⑤ NH4Cl
按上图连接好各仪器,现将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯。部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解,回答下列问题:
(1)A中发生的化学反应方程式为________。制取气体所用到的玻璃仪器主要有_______种(不包括连接装置)。
(2)B装置的作用为____________________________。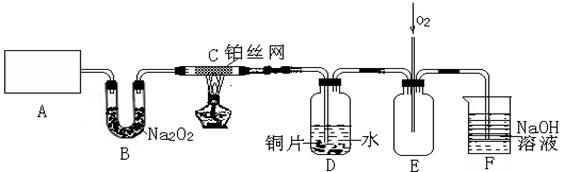 (3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)
(3)D中铜片发生反应的离子方程式为___________________________,为了使Cu片溶解的速率加快,可向D处的溶液中加入下列少量物质中的___________(填下列各项序号)
A.Na2CO3
B.AgNO3
C.H2SO4
D.FeSO4
(4)图E中持续通入氧气的作用为____________________。
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见:_______________________________________________________。
②通过计算说明这次碰撞是弹性碰撞还是非弹性碰撞。
参考答案:(1)Ca(OH)2 +2NH4Cl CaCl2 +2H2O+ 2NH3↑(3分)?2(2分)
CaCl2 +2H2O+ 2NH3↑(3分)?2(2分)
(2)吸收二氧化碳和水蒸气并产生氧气(2分)
(3)3Cu+8H+ + 2NO3-- = 3Cu2+ + 2NO↑+ 4H2O(2分)?B C(2分)
(4)使有害气体吸收更完全(2分)
(5)D装置的液体易倒流入玻璃管C中,使玻璃管破裂,在C装置与D装置之间连接一防倒吸装置。(2分)
本题解析:略
本题难度:一般
2、选择题 下列有关实验操作的说法正确的是
A.加入盐酸以除去硫酸钠中的少许碳酸钠杂质
B.用洁净的玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1 AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp大
D.可用25.00ml碱式滴定管量取20.00ml 溴水
参考答案:
C
本题解析:略
本题难度:简单
3、简答题 某化学兴趣小组从有机废液中(主要含甲苯、二甲苯、苯酚)提取苯酚的流程图如图所示: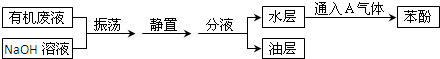
请填写下列空白:
(1)A的化学式是______.
(2)振荡的目的是______.
(3)分液操作需要的最关键的玻璃仪器是______,使用该仪器时第一步操作是______.
(4)写出水层中有关物质与A气体反应生成苯酚的化学方程式:______.
参考答案:苯、二甲苯、苯酚三种物质中只有苯酚和NaOH反应生成溶于水的苯酚钠,经振荡、静置、分液后得到的水层为苯酚钠溶液,由于苯酚的酸性比碳酸弱,在溶液中通入二氧化碳气体可得到苯酚,
(1)由以上分析可知A为CO2,故答案为:CO2;
(2)由于苯、二甲苯、苯酚混溶,为使苯酚与NaOH充分反应,应充分振荡,可使苯酚与NaOH充分接触而反应,
故答案为:使苯酚与氢氧化钠充分反应;
(3)分液时常用分液漏斗分离互不相溶的两种液体混合物,使用前应检验是否漏液,
故答案为:分液漏斗;检验分液漏斗是否漏液;
(4)苯酚的酸性比碳酸弱,在苯酚钠溶液中通入二氧化碳生成苯酚,反应的方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3.
本题解析:
本题难度:简单
4、计算题 (10分)某化学兴趣小组为了测定镁铜合金中镁的质量分数,取出3g合金样品,将60g稀硫酸分6次加入样品中,充分反应后过滤、洗涤、干燥、称重,得到的实验数据如下:
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.5g |
| 第四次加入10g | 1.0g |
| 第五次加入10g | 0.6g |
| 第六次加入10g | 0.6g |
参考答案:(1) Cu (1分)? 5? (1分)? 2.5 (1分)? (2) 80%? (3分)? (3) 20.4%(3分)
本题解析:(1)铜和稀硫酸不反应,所以最后剩余的是铜。根据实验2、3可知,10g稀硫酸就能溶解0.5g合金。所以m=3g-0.5g=2.5g。在实验4、5中溶解的合金质量是0.4g,这说明在第5次加入稀硫酸时样品中的镁已经完全反应.
(2)铜是0.6g,所以镁是2.4g,则镁的质量分数是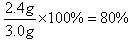
(3)10g稀硫酸就能溶解0.5g镁,所以根据方程式Mg+H2SO4=MgSO4+H2↑,10g稀硫酸中含有溶质是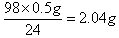 ,所以稀硫酸的质量分数是2.04g÷10.0g×100%=20.42%。
,所以稀硫酸的质量分数是2.04g÷10.0g×100%=20.42%。
本题难度:一般
5、实验题 (15 分)
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线: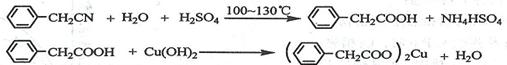
制备苯乙酸的装置示意图如下(加热和夹持装置等略):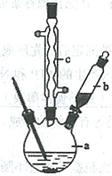
已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
?。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是?;仪器c的名称是?,其作用是?。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是?。下列仪器中可用于分离苯乙酸粗品的是?(填标号)。
A.分液漏斗
B.漏斗
C.烧杯
D.直形冷凝管E.玻璃棒
(3)提纯粗苯乙酸的方法是?,最终得到44 g纯品,则苯乙酸的产率是?。
(4)用CuCl2? ? 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是?。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是?。
参考答案:
⑴先加水、再加入浓硫酸(1分)
⑵滴加苯乙腈(1分)球形冷凝管(1分) 回流(或使气化的反应液冷凝)(1分)
便于苯乙酸析出(2分) BCE(全选对2分)
⑶重结晶(1分)?95%( 2分)
⑷取少量洗涤液、加人稀硝酸、再加AgN03溶液、无白色浑浊出现(2分)
⑸增大苯乙酸溶解度,便于充分反应(2分)
本题解析:⑴蒸馏水与浓硫酸混合应先加水、再加入浓硫酸,防止暴沸。
⑵仪器b为分液漏斗,通过分液漏斗向三口瓶a中滴加苯乙腈;仪器c为球形冷凝管,能起到冷凝回流的作用(使气化的反应液冷凝);反应结束后加适量冷水,便于苯乙酸(微溶于冷水)结晶析出,通过过滤能从混合液中分离出苯乙酸粗品,过滤所用的仪器主要有漏斗、玻璃棒、烧杯等。
⑶将粗苯乙酸晶体重新在热水中溶解,然后再降温结晶过滤(重结晶)可得较纯净的苯乙酸晶体;根据“1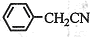 ~1
~1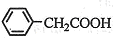 ”关系式,可计算苯乙酸的产率=
”关系式,可计算苯乙酸的产率=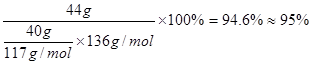 。
。
⑷在制备Cu(OH)2沉淀的同时还有可溶性NaCl生成,故判断沉淀洗干净的方法就是检验最后一次洗涤液中是否还含有Cl-。
⑸根据“苯乙酸微溶于冷水,溶于乙醇”,故乙醇与水的混合溶剂中的乙醇能增大苯乙酸的溶解度,便于充分反应。
本题难度:一般