时间:2018-03-17 08:10:41
1、填空题 下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
(1)Zn+Ag2O+H2O Zn(OH)2+2Ag____________________________________________。
Zn(OH)2+2Ag____________________________________________。
(2)2C2H2+5O2 4CO2+2H2O__________________________________________________。
4CO2+2H2O__________________________________________________。
(3)6H2O+6CO2 C6H12O6+6O2______________________________________________。
C6H12O6+6O2______________________________________________。
(4)CaCO3 CaO+CO2↑______________________________________________________。
CaO+CO2↑______________________________________________________。
参考答案:(1)放电时化学能转化为电能,充电时电能转化为化学能
(2)化学能转化为热能
(3)太阳能(光能)转化为化学能
(4)热能转化为化学能
本题解析:能量可以相互转化,能量间的转化形式是多种多样的,根据化学反应的条件和反应实质可以判断。
本题难度:简单
2、填空题 (18分)实验是化学学习的基础,请完成以下实验填空:
Ⅰ.(1)常压下,已知甲烷的热值是55.625KJ/g,请写出甲烷燃烧热的热化学方程式 。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。若实验中大约要使用245 mL NaOH溶液,配制0.50 mol/L NaOH溶液时至少需要称量NaOH固体 g。
(3)测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。装置中环形玻璃搅拌棒的搅拌方法是 ,该实验过程中量筒最少要准备 个。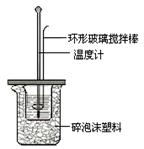
(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的a= &# 160; ℃
| 温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | a |
| 2 | 27.0 | 27.4 | 27.2 | 31.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 31.4 | |
 实验 实验混合溶液 | A | B | C | D | E | F |
| 4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
参考答案:Ⅰ、(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890kJ/mol (2)5.0 (3)上下移动 2
(4)① 4.0(2分) ② -53.5 kJ/mol ③ a c d
Ⅱ、(1)硫酸铜与锌反应产生的铜与锌可形成铜—锌原电池加快了锌与硫酸产生氢气的速率
(2)V1=30 V9=17.5
(3)当加入一定量硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与硫酸的接触面积而使反应速率下降
本题解析:
试题解析:Ⅰ.(1)常压下,已知甲烷的热值是55.625KJ/g,则1mol甲烷完全燃烧放出的热量为=55.625KJ/g×16g/mol=890KJ/mol,甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890kJ/mol;(2)实验中大约要使用245 mL NaOH溶液,配制0.50 mol/L NaOH溶液时,容量瓶的规格为250ml,需要称量NaOH固体=0.5mol/L×0.25L×40g/mol=5.0g;(3)测定稀硫酸和稀氢氧化钠中和热的实验中环形玻璃搅拌棒的搅拌方法是环绕温度计上下移动,该实验过程中量筒最少要准备2个,一个量算,另一个量碱;(4)①根据表中数据可知,温度的差值是(℃)4.0、4.1、3.9、5.1,所以根据表中数据实验4的误差太大,舍去。因此温度差的平均值是(4.0+3.9+4.1)℃÷3=4.0℃;②反应中生成0.025mol水,所以反应热△H=-0.00418×4.0×80÷0.025=-53.5 kJ/mol;③53.5 kJ/mol小于57.3 kJ/mol,选项a有热量损失,测定结果偏小;配制0.50 mol/L NaOH溶液时俯视刻度线读数时,浓度偏大,测定结果偏高;次数越多,热量损失越多;用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,则温度差值减小,测定结果偏小;用量筒量取NaOH溶液的体积时仰视读数,则氢氧化钠的体积增加,测定结果偏高,实验答案选acd;Ⅱ.(1)Zn和硫酸的反应中加入少量的CuSO4溶液,能置换出一定量Cu,在溶液中形成Cu/Zn原电池,而加快化学反应速率;(2)要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,B组中硫酸30ml,水为0,那么总量为20ml,所以V9=17.5ml,V1=30ml.
考点:燃烧热、中和热、化学反应速率
本题难度:一般
3、选择题 已知热化学方程式: H2O(g)=H2(g) +1/2O2(g) △H = +241.8kJ/mol
H2(g)+ 1/2O2(g)=H2O(1) △H =" -" 285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是 ( )
A.吸热44kJ
B.吸热2.44KJ
C.放热44kJ
D.放热2.44KJ
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列各组反应中,第一个反应放出的热量比第二个反应放出的热量多的是
(g、l、s分别表示气体、液体、固体) ( )
A.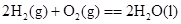
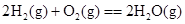
B.C(石墨)+O2(g)===CO2(g) C(金刚石)+O2(g)===CO2(g) (石墨比金刚石稳定)
C.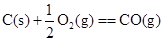
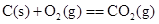
D.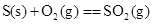
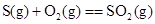
参考答案:A
本题解析:由于液态水的能量,低于气态水的能量,则氢气完全燃烧生成液态水时放热多,所以选项A符合;B中石墨比金刚石稳定,这说明石墨的总能量低于金刚石的总能量,所以金刚石燃烧放出的热量多;C中碳完全燃烧放热多;D中固态S的总能量低于气态S的总能量,所以气态S完全燃烧放热多,答案选A。
考点:考查反应热的有关计算和判断
点评:该题是高考中的常见题型和重要的考点,属于中等难度的试题。试题基础性强,主要是考查学生对影响反应热大小因素的熟悉掌握程度。该题的关键是明确反应热的大小只与反应物和生成物总能量的相对大小有关系,而物质的状态也和物质自身的能量有关系,然后结合题意灵活运用即可。
本题难度:简单
5、选择题 含有下列键型的物质,可能为单质的是
A.只有离子键的物质
B.既有离子键,又有非极性键的物质
C.既有极性键,又有离子键的物质
D.只有非极性键的物质
参考答案:D
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。所以含有离子键的物质一定是离子化合物。由于由同一种元素的形成的共价键是非极性键,所以选项D中一定是单质,答案选D。
点评:该题是中等难度的试题,主要是考查学生对化学键含义以及化学键与物质关系的熟悉了解程度,意在巩固学生的基础,提高学生的能力。有利于培养学生的逻辑推理能力和创新思维能力。
本题难度:一般