时间:2018-03-17 07:42:34
1、实验题 某同学在气体体积测定仪中用镁和硫酸反应测定1 mol氢气体积。完成下列填空: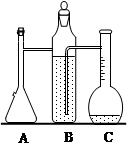
(1)A中发生反应的离子方程式为______________________。
(2)检查装置气密性的方法是塞上B瓶的玻璃塞,用橡皮塞塞紧A瓶加料口,当看到__________________现象时,可以确认装置气密性良好。
(3)已知液体量瓶的刻度范围是110~130 mL,实验时称取镁带的质量要控制在0.100~0.110 g之间,目的是_________。
(4)完成一次测定实验,需要2次用注射器抽气,其中需要记录的是第__________次抽出气体的体积。
(5)下列情况会导致实验结果偏高的是______(填编号)
a. 镁表面的氧化膜没有除尽? b. 储液瓶中的液体是水
c. 未冷却到室温就读数? d. 装置气密性不好
2、实验题 测某种含有少量氧化钠的过氧化钠试样的质量分数。
方法一:利用下图装置测定混合物中Na2O2的质量分数,已知试样质量为1.560g、锥形瓶和水的质量为190.720g,每隔相同时间读得电子天平的数据如表:
(1)写出Na2O2和H2O反应的化学方程式________________
(2)该试样中过氧化钠的质量分数为____________________(保留3位有效数字)
不必作第6次读数的原因是____________________________________
方法二:测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
(3)操作Ⅱ的名称是________________________
(4)需直接测定的物理量是______________________________
(5)测定过程中需要的仪器有电子天平、蒸发皿、酒精灯、还需要________、_______(固定、夹持仪器除外)
(6)在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果__________________
(填偏大、偏小或不变)。
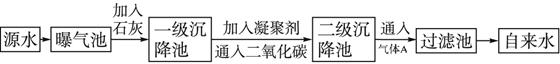
方法三:请从下图中选用适当仪器测定混合物中Na2O2的质量分数,要求操作简单。
除待测试样外,限选试剂:CaCO3固体,6mol/L盐酸和蒸馏水
(7)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)__________________。
3、实验题 某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
【药品】NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
【实验方案】
【问题探究】
(1)步骤Ⅱ所发生反应的离子方程式为____________________
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有
Zn2++4OH-=ZnO22-+2H2O和_______________________
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为_______________________
(4)欲实现步骤V,所需加入的试剂有____、____, 所涉及的主要操作依次为________________
(5)步骤Ⅳ常用的方法是___________,该步骤是否对环境有影响?_______(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应____________________
4、实验题 用如图所示装置进行实验,将A逐滴加入B中。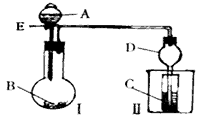
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到C中溶液褪色,则B是_______,然后往烧杯中加入沸水,又可观察到的现象是________。
(2)若B为Na2CO3,C为NaAlO2溶液,实验中观察到小试管内溶液变浑浊,则酸A的酸性比_______强,写出试管C中反应的离子方程式__________。
(3)若B是生石灰,实验中观察到C中溶液由无色变为红色,若在C中加入醋酸铵固体红色变浅,则A是__________,解释C中加入醋酸铵固体红色变浅的原因:__________(用方程式及必要的文字说明) 。
5、填空题 我国规定饮用水质量标准必须符合下列要求:
| pH | 6.5~8.5 |
| Ca2+、Mg2+ | <0.004 5 mol·L-1 |
| 细菌总数 | <100个/mL |