时间:2018-03-17 07:36:35
1、选择题 水中加入下列溶液对水的电离平衡不产生影响的是
A.NaHSO4溶液
B.NaOH溶液
C.KAl(SO4)2溶液
D.KI溶液
参考答案:D
本题解析:水是弱电解质,存在电离平衡H2O H++OH-。所以酸或碱都能抑制水的电离,而能发生水解的盐,则是促进水的电离,即A和B抑制水的电离,C促进水的电离,碘化钾比强酸强碱盐,不能水解,不会影响水的电离平衡,答案选D。
H++OH-。所以酸或碱都能抑制水的电离,而能发生水解的盐,则是促进水的电离,即A和B抑制水的电离,C促进水的电离,碘化钾比强酸强碱盐,不能水解,不会影响水的电离平衡,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的关键是理解并掌握外界条件对水电离平衡影响,然后结合题干灵活运用即可。
本题难度:简单
2、选择题 常温下Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16,将等体积的AgCl和AgI的饱和溶液的清液混合,再向其中加入一定量的AgNO3固体,下列说法正确的是( )
A.两清液混合,AgCl和AgI都沉淀
B.向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大
C.若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主
D.若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L
参考答案:A、饱和的AgCl溶液中:c(Ag+)=c(Cl-)=1.342×10-5,
饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,
等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6
明显,混合后,AgI必然沉淀,AgCl则不然.故A错误;
B、Ksp与温度有关,温度不变,Ksp不变,故B错误;
C、由于c(Cl-)》c(I-),若AgNO3固体足量,沉淀以AgCl为主,C正确;
D、常温下,氯化银的溶解度为:1.342×10-5×143.5═0.001.92(g),c(Cl-)═1.342×10-5mol/L,0.1435克AgCl只有少量溶解,故c(Cl-)═1.342×10-5mol/L,故D错误.
故选C.
本题解析:
本题难度:一般
3、选择题 一定温度下,石灰浆中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),当向一定量的石灰浆中加入少量生石灰后并恢复到原来的温度,下列说法正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰浆中加入少量生石灰后并恢复到原来的温度,下列说法正确的是
A.溶液中Ca2+离子数目减少
B.溶液中c(Ca2+)增大
C.溶液的pH增大
D.溶液中溶质的质量分数增大
参考答案:A
本题解析:
石灰浆中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),可知石灰浆为Ca(OH)2的饱和溶液,加入少量生石灰(CaO)后,CaO+H2O=Ca(OH)2,消耗水,使石灰浆变为过饱和溶液,有Ca(OH)2的固体析出,所以溶液中Ca2+离子数目减少,剩余石灰浆仍为饱和溶液,即c(Ca2+)、c(OH-)均不变,溶液中溶质的质量分数也不变。
Ca2+(aq)+2OH-(aq),可知石灰浆为Ca(OH)2的饱和溶液,加入少量生石灰(CaO)后,CaO+H2O=Ca(OH)2,消耗水,使石灰浆变为过饱和溶液,有Ca(OH)2的固体析出,所以溶液中Ca2+离子数目减少,剩余石灰浆仍为饱和溶液,即c(Ca2+)、c(OH-)均不变,溶液中溶质的质量分数也不变。
A、因为有Ca(OH)2的固体析出,所以溶液中Ca2+离子数目减少,故A正确;
B、剩余石灰浆仍为饱和溶液,且温度不变,所以c(Ca2+)、c(OH-)均不变,故B不正确;
C、c(OH-)不变,故PH不变,故C不正确;
D、温度不变,剩余石灰浆仍为饱和溶液,溶液中溶质的质量分数也不变,故D不正确。
考点:考查沉淀的溶解平衡
点评;本题考查了沉淀的溶解平衡及其影响因素,难度不大。本题的易错点是忽略了存在沉淀溶解平衡的体系中物质的状态是饱和的。
本题难度:一般
4、选择题 把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(固)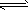 Ca2++2OH-加入以下物质,可使
Ca2++2OH-加入以下物质,可使
Ca(OH)2(固)减少的是
[? ]
A.NaCl
B.AlCl3溶液
C.NaOH
D.CaCl2
参考答案:B
本题解析:
本题难度:一般
5、选择题 (2011·焦作市高二期末)在下列溶液中,BaSO4的溶解度最大的是( )
A.1 mol/L H2SO4溶液
B.2 mol/L Na2SO4溶液
C.0.1 mol/L BaCl2溶液
D.纯水
参考答案:D
本题解析:固体BaSO4存在溶解平衡,BaSO4(s)? ?Ba2+(aq)+SO42-(aq),H2SO4溶液、Na2SO4溶液、BaCl2溶液均能使溶解平衡向左移动,从而降低BaSO4的溶解度,故在纯水中BaSO4的溶解度最大,D正确。
?Ba2+(aq)+SO42-(aq),H2SO4溶液、Na2SO4溶液、BaCl2溶液均能使溶解平衡向左移动,从而降低BaSO4的溶解度,故在纯水中BaSO4的溶解度最大,D正确。
本题难度:一般