时间:2018-03-17 07:36:35
1、选择题 下列叙述正确的是
[? ]
A.可以根据PbI2和AgCl的Ksp的大小比较两者的溶解能力
B.常温下,同浓度的Na2S与NaHS溶液相比,NaHS溶液的pH大
C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D.能使碘化钾淀粉试纸变蓝的溶液中,Na+、S2-、Br-、NH4+等离子可以大量共存
参考答案:C
本题解析:
本题难度:一般
2、选择题 某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )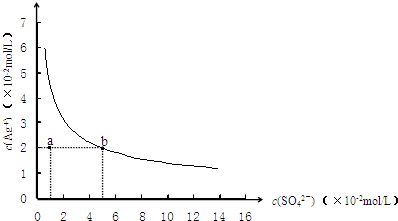
A.含有大量SO42-的溶液中肯定存在Ag+
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
参考答案:A.Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),溶解为可逆过程,溶液中一定存在Ag+,故A正确;
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(SO42-)=0.1mol/L时,c(Ag+)=0.01mol/L,c2(Ag+)×c(SO42-)=1×10-5<ksp,不会生成沉淀,故B正确;
C.由图象可知,当c(SO42-)=5×10-2mol/L时,c(Ag+)=2×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=2×10-5,故C错误;
D.a点c(SO42-)=1×10-2mol/L,c(Ag+)=2×10-2mol/L,c2(Ag+)×c(SO42-)=4×10-6<ksp,不是饱和溶液,温度升高,物质溶解度也增大,溶度积常数增大,蒸发不能使溶液由a点变到b点,故D错误.
故选AB.
本题解析:
本题难度:简单
3、选择题 下列说法正确的是
A.在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿
B.常温下,将pH= 4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.反应SiO2(s)+ 3C(s)=SiC(s) + 2CO(g)室温下不能自发进行,则该反应的△H<0
D.对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小
参考答案:D
本题解析:A、在潮湿的环境中,铜容易发生吸氧腐蚀形成铜绿,A错误;B、醋酸是弱电解质,存在电离平衡,稀释促进电离,因此常温下,将pH=4的醋酸溶液稀释后,溶液中氢离子和醋酸根离子的浓度均降低,但氢氧根离子浓度增大,B错误;C、由于反应SiO2(s)+ 3C(s)=SiC(s) + 2CO(g)的△S>0,所以根据△G=△H-T·△S可知,室温下不能自发进行,则该反应的△H>0,C错误;D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,但氢氧化钙的溶解度降低,因此Ksp减小,D正确,答案选D。
考点:考查金属腐蚀、弱电解质的电离、反应自发性以及溶解平衡等
本题难度:一般
4、选择题 下列说法正确的是
[? ]
A.常温下,Fe(OH)2在水中能自发地转化为Fe(OH)3,该反应的△H<0
B.在NaHSO3溶液中滴入石蕊试液,验证NaHSO3溶液中存在水解平衡
C.在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl,则Ksp(AgCl)<Ksp(Ag2CrO4)
D.医院可以用BaCO3代替BaSO4做“钡餐”给病人进行胃部透视
参考答案:A
本题解析:
本题难度:一般
5、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O===Cu(OH)2↓+CO2↑
次要:Cu2++CO32-===CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-===CuS↓
次要:Cu2++S2-+2H2O===Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是
[? ]
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
参考答案:A
本题解析:
本题难度:一般