时间:2018-03-17 07:34:41
1、选择题 下列操作会导致实验结果偏高的是( )
A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值
B.中和滴定测定盐酸浓度,量取20.00 mL盐酸时未用待测液润洗酸式滴定管
C.用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量
D.配制一定物质的量浓度溶液时,用量筒量取浓溶液体积仰视读数,所配溶液的浓度
参考答案:D
本题解析:A.中和热测定实验中,若用铜制环形搅拌器代替环形玻璃搅拌棒,由于Cu导热性强,是热量散失多,则所测中和热的数值偏小,错误;B.中和滴定测定盐酸浓度,量取20.00 mL盐酸时未用待测液润洗酸式滴定管,则由于浓度偏小,使其物质的量偏少,测定时消耗的标准碱溶液物质的量偏少,因此酸的浓度就偏低,错误;C.用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量小于10.5g,偏小,错误;D.配制一定物质的量浓度溶液时,用量筒量取浓溶液体积仰视读数,所配溶液的浓度,则酸液偏大,因此所配溶液的浓度就偏大,正确。
考点:考查化学实验过程中的误差分析的知识。
本题难度:一般
2、填空题 依据事实,写出下列反应的热化学方程式。
(1)在25℃、101 kPa下,1 g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为 ______________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为_______________________________________________。
参考答案:(1)CH3OH(l)+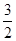 O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1
(2)N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1
本题解析:(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以1mol甲醇完全燃烧放出的热量是22.68 kJ×32=725.76 kJ,则示甲醇燃烧热的热化学方程式为CH3OH(l)+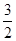 O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1。
O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1。
(2),每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为N2(g)+2O2(g)===2NO2(g) ΔH=+67.8 kJ·mol-1。
考点:考查热化学方程式的书写
点评:该题是基础性试题的考查,侧重对学生基础知识的训练。该题的关键是明确热化学方程式的含义以及书写注意事项,有利于培养学生规范的答题能力,提高学生的应试能力和学习效率。
本题难度:一般
3、选择题 下列说法中正确的是
A.分子中键能越大,键长越长,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间可能形成共价键
C.PCl5分子中P原子和Cl原子最外层都满足8电子结构
D.H—O键键能为463 kJ/mol,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ
参考答案:B
本题解析:分子中键能越大,键长越短,则分子越稳定,A不正确。根据电负性可知碘和锂可能形成共价键,B正确。C不正确,PCl5分子中P原子最外层是10电子结构.。D不正确,由于在形成氢气和氧气是会放出热量,18 g H2O分解成H2和O2时,消耗能量小于2×463 kJ。答案选B。
本题难度:一般
4、选择题 吸热反应一定是(?)
A.释放能量
B.储存能量
C.反应物的总能量低于生成物的总能量
D.反应物的总能量高于生成物的总能量
参考答案:BC
本题解析:吸热反应是一个把热能等转化为物质内部的能量被“贮存”起来的过程,造成反应物的总能量低于生成物的总能量
本题难度:简单
5、选择题 氮化铝(AlN)是一种熔点很高、硬度大、不导电、难溶于水和其他溶剂的晶体。将下列各组物质加热熔化或汽化,所克服粒子间的作用力与AlN克服粒子间的作用力都相同的是
A.水晶,金刚石
B.食盐,硫酸钾
C.碘,硫
D.石墨,硅
参考答案:A
本题解析:熔点很高、硬度大、不导电等性质是原子晶体的特点。水晶、金刚石和氮化铝(AlN)一样都属于原子晶体,熔化时所克服的作用力一样,都是共价键。
本题难度:简单