时间:2018-03-17 07:34:41
1、实验题 50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
2、选择题 下列化合物中,含有极性共价键的是( )
A.H2O
B.Cl2
C.NaCl
D.Na2O
3、选择题 下列叙述与对应图式正确的是
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 主要化合价 | -2 | +2 | +1 | +5、-3 | +7、-1 | +1 | +5、-3 | +3 |
4、填空题 (9分)“西气东输”是西部开发的重点工程,这里的“气”是指天然气,其主要成分是甲烷。水煤气中主要成分是CO和H2,二者的体积比为l :l。已知:在120℃和一个大气压下,H-H键能为436 kJ/mol,O=O键能为496 kJ/mol,H-O键能为463 kJ/mol ;1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;l mol CH4气体完全燃烧生成CO2气体和气态水放出802 kJ热量。
(1)写出120℃和一个大气压下,H2完全燃烧生成气态水的热化学方程式 ;
(2)相同条件下,若l mol CH4气体完全燃烧生成CO2气体和液态水,放出的热量 802 kJ;(选填“>”、“=”、“<”)
(3)忽略水煤气中其他成分,燃烧等体积的CH4和水煤气,所得热量之比约为 ;
(4)请结合以上计算结果,叙述相比于水煤气,天然气作为燃料的两个优点:
。
5、选择题 根据键能数据估算CH4(g)+4F2(g) =CF4+4HF(g)的反应热ΔH为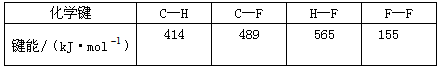
[? ]
A.-1940 kJ · mol-1
B.1940 kJ · mol-1
C.-485 kJ · mol-1
D.485 kJ · mol-1