时间:2018-03-17 07:17:59
1、填空题 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体。在合适的反应条件下,它们可以按下面框图进行反应,又知E溶液是无色的。请回答: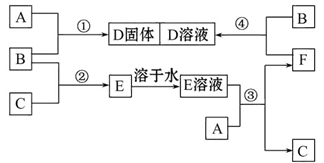
(1)A是_______、B是_______、C是_______ (请填化学式)。
(2)反应①的化学方程式为: ___________________________________。
(3)反应③的离子方程式为: _________________________________________。
(4)反应④的离子方程式为:___________________________________________。
参考答案:(1)Fe? Cl2? H2
(2)2Fe+3Cl2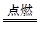 2FeCl3
2FeCl3
(3)2H++Fe=Fe2++H2↑
(4)2Fe2++Cl2=2Fe3++2Cl-
本题解析:本题的突破口是B为黄绿色气体。据中学所学知识可知,B为Cl2。结合B(Cl2)+C(无色气体)→E→E溶液,可推测C为H2,E为HCl。再结合:A(s)+B(Cl2) →D(s); E(溶液)+A(s) →C(H2)+F;F+B(Cl2) →D(溶液),可推测A为Fe,F为FeCl2,D为FeCl3。
本题难度:一般
2、计算题 (9分)向Fe3O4和 Fe的固体混合物6.88g中加入50ml 2 mol·L—1H2SO4,恰好使固体完全溶解,并放出一定量气体。在所得溶液中加入KSCN溶液,溶液不变红色。
(1)?写出Fe3O4和稀H2SO4反应的化学方程式______________________________。
(2)?混合物中Fe3O4和 Fe的物质的量(写出计算过程)。
(3)?求反应中产生的气体在标准状况下的体积。(写出计算过程)。
若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量。(写出计算过程)。
参考答案:(1)Fe3O4+4H2SO4==FeSO4+Fe2(SO4)3+4H2O(1分)
(2)n(Fe3O4)="0.02" mol;? n(Fe)="0.04" mol 。(每空2分)
(3)448ml(2分)?(4)5.6g(2分)
本题解析:(2)设Fe、Fe3O4的物质的量分别为n1,n2,
56n1+232n2="6.88g" ①
据题意,得:反应过程中,发生了以下3个反应,
Fe3O4+4H2SO4==FeSO4+Fe2(SO4)3+4H2O? Fe+Fe2(SO4)3=3FeSO4?Fe+H2SO4=FeSO4+H2↑
1? 4? 1? 1? 1? 1? 1?
n2? 4n2? n2? n2 ?n2?(n1- n2)(n1- n2)
则:4n2+(n1- n2)=0.05L×2 mol·L—1="0.1mol" ②
联立①②,得n1="0.04mol" ,n2=0.02mol
(3)V(H2)=22.4L.mol-1×(n1- n2)= 448ml
(4) Fe3O4+4CO=高温=3Fe+ 4CO2
1? 3
0.02mol? 0.06mol
最终能得到铁的质量:(0.06mol+0.04mol)×56g.mol-1=5.6g
本题难度:一般
3、填空题 (9分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列各题。
(1)所含铁元素既有氧化性又有还原性的物质是(?)(用字母代号填)。
A.Fe
B.FeCl3
C.FeSO4
D.Fe2O3
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中微粒直径的范围是____________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的化学方程式:__________________;检验反应后的溶液中存在Fe3+的试剂是_____________,该反应的离子方程式为__________________________。
参考答案:(1)C?(1分)(2)? 1~100?(每空2分)
(3)2FeCl3+Cu=2FeCl2+CuCl2; KSCN? Fe3++SCN-=[Fe(SCN)]2+(每空2分)
本题解析:(1)要让铁元素既有氧化性又有还原性,则其化合价必须处于中间价态。A、B、C、D四种物质中铁的化合价分别为0价、+3价、+2价和+3价。所以选项C正确。
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,此时所得的分散系属于胶体,微粒直径的范围是1~100nm。
(3)Fe3+具有氧化性,可氧化铜,方程式为2FeCl3+Cu=2FeCl2+CuCl2。检验Fe3+常用试剂是KSCN,现象是溶液变成红色,方程式为Fe3++SCN-=[Fe(SCN)]2+。
本题难度:一般
4、选择题 在FeCl2、CuCl2和FeCl3的混合溶液中加入铁粉,充分反应后,滤出的不溶物中除铜粉外,还有少量铁粉,则滤液中
A.肯定有Fe2+,可能有Fe3+
B.肯定有Fe3+,一定没有Cu2+
C.肯定有Cu2+,一定没有Fe3+
D.肯定有Fe2+,一定没有Fe3+和Cu2+
参考答案:D
本题解析:略
本题难度:简单
5、填空题 某氯化亚铁和氯化铁的混合物。现要测定其中铁元素的质量分数,按以下步骤
进行实验: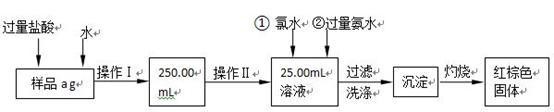
Ⅰ.请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、胶头滴管、玻璃棒外,还必须有?。(填仪器名称)
(2)请写出加入氯水发生的离子反应方程式?。
(3)将沉淀物加热、灼烧,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是?
?;蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是?。?
Ⅱ.有同学提出,还可以采用以下方法来测定: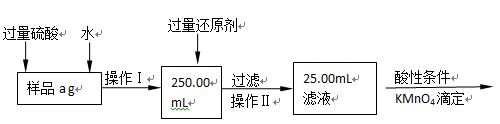
(1)选择的还原剂是否能用铁?(填“是”或“否”),原因是:?;
(2)若滴定用掉c mol?L-1 KMnO4溶液b mL,则样品中铁元素的质量分数是:?。
参考答案:(11分)Ⅰ.(1)250mL容量瓶(1分)(2)2Fe 2++ Cl2= 2Fe 3++ 2Cl-(2分)
(3)再次加热冷却并称量,直至两次质量差小于0.1g(1分)
铁元素的质量分数是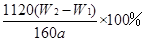 (2分)
(2分)
Ⅱ.(1)否(1分)如果用铁做还原剂,自身的氧化产物是Fe2+;且会与过量的硫酸反应生成Fe2+,干扰铁元素的测定(2分,答出一个原因即给2分)
(2)铁元素的质量分数是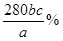 (2分)
(2分)
本题解析::Ⅰ、(1)因配制一定物质的量浓度的溶液所需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、一定规格的容量瓶,所以还需要的仪器有250mL容量瓶。
(2)氯水具有强氧化性,能把亚铁离子氧化生成铁离子,反应的离子方程式2Fe 2++ Cl2= 2Fe 3++ 2Cl-。
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g;因铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为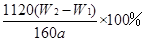 。Ⅱ.(1)还原剂不能用铁,因为铁会和过量稀硫酸反应生成硫酸亚铁,再用高锰酸钾滴定,多消耗氧化剂产生误差,干扰原混合物的铁元素的测定。
。Ⅱ.(1)还原剂不能用铁,因为铁会和过量稀硫酸反应生成硫酸亚铁,再用高锰酸钾滴定,多消耗氧化剂产生误差,干扰原混合物的铁元素的测定。
(2)设铁元素质量分数为x,则依据反应5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O可知5Fe2+~5Fe3+~KMnO4
5×56?1
a×x×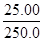 ? 0.001bc
? 0.001bc
则铁元素的质量分数是x=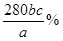
点评:该题是中等难度的试题,也是高考中的常见题型。试题针对性强,主要是考查学生实验分析,实验数据的计算应用,同时考查了实验知识的分析判断能力,有利于培养学生的综合实验能力,也有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。
本题难度:一般