时间:2018-03-17 07:17:59
1、选择题 在FeCl3和CuCl2混合液中,加入一定量的铁粉,充分反应后,溶液中的金属离子不可能是
A.有Fe2+
B.Cu2+、Fe2+ 和Fe3+
C.仅有 Fe3+ 和Fe2+
D.有Cu2+和Fe2+
参考答案:C
本题解析:因为三价铁离子先和铁粉反应,所以在有单价铁离子的情况下一定有铜离子,所以C错误。
本题难度:一般
2、填空题 铁黄是一种重要的颜料,化学式为Fe2O3·xH2 O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含FeZ 0。及少量的CaO, Mg0等)和黄铁矿粉
(主要成分为FeS2)制备铁黄的流程如下: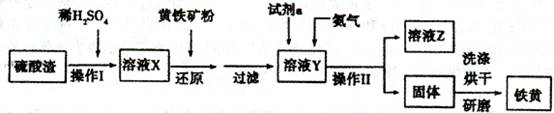
(1)操作I与操作II中都用到玻璃棒,玻璃棒在两种操作中的作用分别是_?、?
(2)试剂a最好选用_?(供选择使用的有:铝粉、空气、浓HNO3 );其作用是_?。
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是_?_(填序号)。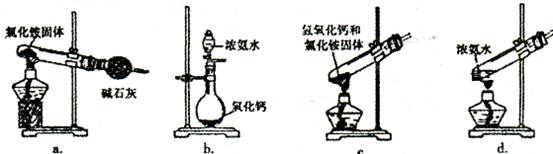
(4)查阅资料知,在不同温度下Fe2 O3被CO还原,产物可能为Fe3 O4?、FeO或Fe,固体质量与反应温度的关系如右图所示。根据图象推断670℃时Fe2 O3还原产物的化学式为M,并设计一个简单的实验,证明该还原产物的成分(依次填写每步操作中所加试剂的化学式、现象和结论)。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2 O2溶液、NaOH溶液、KSCN溶液。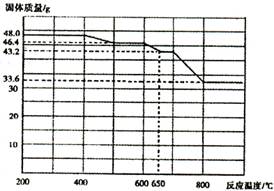
| 加入试剂 | 现象 | 结论 |
| ? | ? | 则还原产物为? |
| ? | ? | |
| ? | ? |
参考答案:
(1)搅拌加速溶液;引流。(2)空气;作氧化剂,将二价铁离子氧化为三价铁离子;(3)bd; (4)
加入试剂
现象
结论
稀硫酸或稀盐酸
固体完全溶解且无气泡产生
则还原产物为FeO?
KSCN溶液
溶液不变色
H2O2溶液
溶液变为红色
本题解析:(1)操作I是搅拌加速溶液溶解,操作II是过滤操作,主要用到玻璃棒引流。(2)试剂a最好选用空气,来源廉价,其作用是作氧化剂,将二价铁离子氧化为三价铁离子。(3)实验室制氨气的主要是操作简单,制作方便,由于氨气易溶于水,故要加热,可选择bd。(4)对于二价铁离子有无可用KSCN溶液不显红色判断,对于有无固体铁可用加入酸有无气泡做出判断。CO还原氧化铁的还原产物为可能Fe3O4,FeO和Fe,Fe2O3加热温度可达到500℃~600℃,质量由46.4g减少为45g,还原产物为Fe3O4;650℃~700℃时,质量由43.2g减少较大,还原产物为FeO,为验证还原产物,在适量待检物中加入稀H2SO4至完全溶解,再加入少量高锰酸钾溶液,溶液紫色褪去,可说明还原产物为FeO,故答案为:Fe3O4;在适量待检物中加入稀H2SO4至完全溶解,再加入少量高锰酸钾溶液,溶液紫色褪去。
加入试剂
现象
结论
稀硫酸或稀盐酸
固体完全溶解且无气泡产生
则还原产物为FeO?
KSCN溶液
溶液不变色
H2O2溶液
溶液变为红色
考点:
本题难度:困难
3、简答题 查阅资料:CaO、MgO在高温下与C难反应,但能与SiO2反应.硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),该烧渣可用于制取氧化铁,具体化工生产工艺流程如下:
(1)焙烧时产生的主要有害气体是______.
(2)为测定过滤所得滤液中Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,写出该反应的离子方程式:______;实验中所用酸性高锰酸钾溶液浓度为0.10mol/L,滤液用______滴定管量取20.00ml,用酸性高锰酸钾溶液滴定到终点时消耗了标准的酸性高锰酸钾溶液12.04ml,滤液中c(Fe2+)=______.
(3)若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是:______(用离子方程式表示).
(4)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 开始沉淀的pH 3.10 2.01 7.11 万全沉淀的pH 4.77 3.68 9.61 |
参考答案:(1)硫铁矿烧渣是一种工业废渣(含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质),依据流程分析,加入碳还原会和二氧化硅反应生成硅和一氧化碳,硫铁矿燃烧会生成二氧化硫,生成的污染性气体为一氧化碳和二氧化硫,
故答案为:CO、SO2;
(2)依据高锰酸钾溶液氧化亚铁离子为铁离子,本身被还原为锰离子,依据电荷 守恒,电子守恒,原子守恒配平书写离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,滤液呈酸性需要用酸性滴定管取用,依据离子方程式计算得到滤液中亚铁离子物质的量,
MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
1 5
0.10mol/L×0.012.04l n(Fe2+)
n(Fe2+)=0.00602mol
得到亚铁离子的浓度为0.00602mol0.02L=0.0301mol/L,
故答案为:酸式,0.0301mol/L;
(3)在空气中“酸浸”时间过长,溶液中Fe2+含量将下降的原因是亚铁离子在酸性溶液中被氧气氧化为铁离子,反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;
(4)除去Fe3+和Al3+,依据图表中沉淀所需PH分析,溶液PH小于7.11时,亚铁离子不沉淀,铁离子和铝离子完全沉淀,检验铁离子除KSCN外,可以加入苯酚出现紫色证明铁离子的存在,
故答案为:7.11,苯酚;
(5)将溶液中Fe2+转变为碳酸亚铁沉淀,防止混入杂质,需要对沉淀继续洗涤干燥,
故答案为:洗涤或洗涤、干燥;
本题解析:
本题难度:一般
4、选择题 针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,下列判断错误的是?(?)
A.完全溶解89g针铁矿,需要1.5mol/L的稀盐酸至少2L
B.针铁矿的化学式是FeO(OH)
C.针铁矿中铁元素为+3价
D.44.5g针铁矿约含有6.02×1023个O2。
参考答案:D
本题解析:略
本题难度:简单
5、简答题 把铁、氧化铁、氧化铜的混合物粉末放入110mL4mol?L-1盐酸中,充分反应后产生896mLH2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200ml,测得其中c(H+)为0.4mol?L-1.试求:
(1)残留固体1.28g为:______(填化学式);
(2)原混合物粉末中,m(CuO)=______g;
(3)滤液稀释到200mL后,c(Fe2+)=______mol?L-1;
(4)滤液加水稀释到200mL后,加入足量的硝酸银,产生的沉淀的物质的量:n(AgCl)=______mol;
(5)原混合物的总质量m(总)=______g.
参考答案:既然还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,1.28g固体只有Cu;
而Cu可以残留说明溶液中没有Fe3+,阳离子为H+和Fe2+.反应有:CuO+2H+═Cu2++H2O,
Fe2O3+6H+═2Fe3++3H2O,
Fe+2Fe3+═3Fe2+,
Fe+Cu2+═Fe2++Cu,
Fe+2H+═Fe2++H2↑.
根据原子守恒和得失电子总数相等计算.
设原有Fe为xmol,Fe2O3为ymol,CuO为zmol,
生成Cu为1.28g64g/mol=0.02mol,CuO物质的量为0.02mol
生成H2为0.896L22.4L/mol=0.04mol,
根据得失电子总数相等知:2x=2y+2×0.02+2×0.04;
又根据Cl-知:2(x+2y)+0.2×0.400=0.1×4.40.
将上述两式联立解出:x=0.1,y=0.04.z=0.02mol
原混合物中单质铁的质量56g/mol×0.1mol=5.6g.
(1)依据上述分析可知,最后剩余1.28g固体为铜;
故答案为:Cu;
(2)依据上述计算可知氧化铜物质的量为0.02mol,所以氧化铜质量为m(CuO)=0.02mol×80g/mol=1.6g;
故答案为:1.6;
(3)上述计算可知溶液中亚铁离子物质的量=x+2y=0.1mol+2×0.04mol=0.18mol,c(Fe2+)=0.18mol0.2L=0.9mol?L-1;
故答案为:0.9;
(4)滤液加水稀释到200mL后,加入足量的硝酸银,产生的沉淀的物质的量依据氯元素守恒计算得到,n(AgCl)=0.110L×4mol?L-1=0.44mol;
故答案为:0.44;
(5)计算可知原混合物含有的物质为Fe为0.1mol,Fe2O3为0.04mol,CuO为0.02mol,原混合物的总质量m(总)=0.1mol×56g/mol+0.04mol×160g/mol+0.02mol×80g/mol=13.6g;
故答案为:13.6.
本题解析:
本题难度:一般