时间:2018-03-17 07:13:41
1、填空题 “神七”登天标志着我国的航天事业进入了新的篇章.
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温.为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是______.
A.在高温下不融化?B.在常温下就分解气化?C.在高温下可汽化或者分解D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.已知:
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
NO2(g)?
| 1 2 |
参考答案:(1)涂料起散热作用,因为物质汽化或者分解时从周围吸收热量,从而起到降温作用,故该物质在高温下应该具有汽化或者分解的性质;
故选C;
(2)已知:①、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1
②、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③、NO2(g)?12N2O4(g)△H=-26.35kJ?mol-1
根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) 故△H=2×(-534.0kJ?mol-1)-67.7kJ?mol-1-2×(-26.35kJ?mol-1)=-1073.2kJ?mol-1,
故热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1073.2kJ?mol-1;
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1073.2kJ?mol-1;
(3)原电池正极反应还原反应,氧气在正极放电,正极电极反应式为:O2+2H2O+4e-=4OH-,电池总反应为:N2H4+O2=N2+2H2O,电池总反应式减去正极反应式可得负极电极反应式:N2H4+4OH--4e-=N2+4H2O;
故答案为:O2+2H2O+4e-=4OH-;N2H4+4OH--4e-=N2+4H2O;
本题解析:
本题难度:一般
2、选择题 1840年,俄国化学家盖斯从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的,即盖斯定律。盖斯定律在生产和科学研究中有很重要的作用,有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。已知7.2g碳在12.8g的氧气中燃烧,至反应物耗尽,放出x kJ热量。已知单质碳的燃烧热为y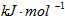 则1mol C与反应生成CO的反应热△H为
则1mol C与反应生成CO的反应热△H为
[? ]
A.-y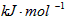
B.-(10x-y)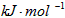
C.-(5x-0.5y)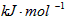
D.-(2.5x-0.5y)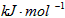
参考答案:D
本题解析:
本题难度:一般
3、选择题 已知:
H2O(g)== H2O(l) △H1==Q1 kJ/mol
C2H5OH(g)==C2H5OH(l) △H2==Q2 kJ/mol
C2H5OH(g)+ 3O2(g)== 2CO2(g)+ 3H2O(g) △H3==Q3kJ/mol
若使用23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
[? ]
A、Q1+Q2+Q3
B、0.5(Q1+Q2+Q3)
C、0.5(Q1-Q2+Q3)
D、1.5Q1-0.5Q2+0.5Q3
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知:Fe2O3(s)+3/2C(s)= 3/2CO2(g)+2Fe(s) △H =+234.1kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 则2Fe(s)+3/2O2(g)=Fe2O3(s)的△H是
[? ]
A.-824.4kJ·mol-1
B.-627.6kJ·mol-1
C.-744.7kJ·mol-1
D.-169.4kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
5、选择题 在298K、100kPa时,已知: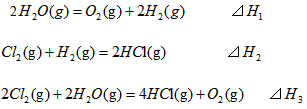
则⊿H1与⊿H2和⊿H3间的关系正确的是
[? ]
A.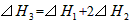
B.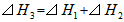
C.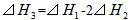
D.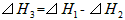
参考答案:A
本题解析:
本题难度:一般