时间:2018-03-17 07:13:41
1、选择题 已知:C(s,金刚石)=C(s,石墨)△H=-1.9KJ/mol
C(s,金刚石)+O2(g)=CO2(g) △H1
C(s,石墨)+O2(g)=CO2(g) △H2
根据已述反应所得出的结论正确的是
[? ]
2、选择题 根据碘与氢气反应的热化学方程式
(i)?I2(g)+?H2(g) 2HI(g)?△H=-9.48?kJ?/mol
2HI(g)?△H=-9.48?kJ?/mol
(ii)?I2(s)+?H2(g) 2HI(g)?△H=+26.48?kJ/mol
2HI(g)?△H=+26.48?kJ/mol
下列判断正确的是
[? ]
A.254g?I2(g)中通入2gH2(g),反应放热9.48?kJ
B.1?mol固态碘与1?mol气态碘所含的能量相差17.00?kJ
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
3、简答题 合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)
3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是______.从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是______.
(2)500℃、50MPa时,在容积为VL的容器中加入n?mol?N2、3n?mol?H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x.则K和x的关系满足K=______.
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g).部分物质的燃烧热数据如下表:
物?质
燃烧热(kJ?mol-1)
H2(g)
-285.8
CO(g)
-283.0
CH4(g)
-890.3
已知1mol?H2O(g)转变为1mol?H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式______.
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式______.
4、填空题 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1: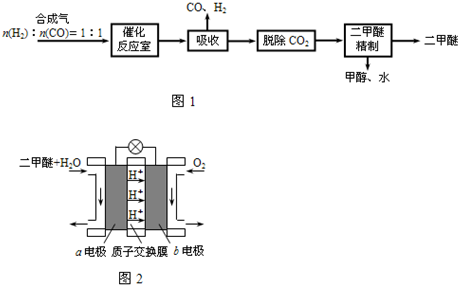
催化反应室中(压力2.0~10.0Mpa,温度300℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol
(1)催化反应室中的总反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g).
该反应的△H=______.催化反应室中采用300℃的反应温度,理由是______.
(2)已知:反应①在300℃时的化学平衡常数为0.27.该温度下将2mol?CO、3mol?H2和2mol?CH3OH充入容积为2L的密闭容器中,此时反应将______(填“正向进行”、“逆向进行”或“处于平衡状态”).
(3)上述流程中二甲醚精制的实验操作名称为______.
(4)图2为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为______.
5、填空题 已知:Na2CO3?10H2O(s)═Na2CO3(s)+10H2O(g)△H1=+532.36kJ?mol-1
Na2CO3?10H2O(s)═Na2CO3?H2O(s)+9H2O(g)△H1=+473.63kJ?mol-1
写出Na2CO3?H2O脱水反应的热化学方程式______.