时间:2018-03-17 07:07:23
1、选择题 关于下列各图的叙述正确的是? 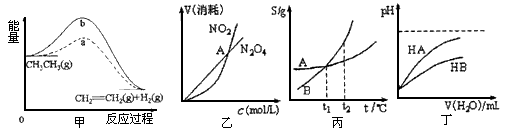
[? ]
A.甲中a、b曲线分别表示反应CH3CH3(g)→CH2=CH2(g)+H2(g)(△H>0),使用和未使用催化剂时,反应过程中的能量变化
B.乙表示恒温恒容条件下发生的可逆反应2NO2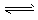 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
参考答案:D
本题解析:
本题难度:一般
2、选择题 将pH=3的盐酸溶液和pH=11的氨水等体积混和后,溶液中离子浓度关系正确的是( )
A.[NH4+]>[Cl-]>[H+]>[OH-]
B.[NH4+]>[Cl-]>[OH-]>[H+]
C.[Cl-]>[NH4+]>[H+]>[OH-]
D.[Cl-]>[NH4+]>[OH-]>[H+]
参考答案:B
本题解析:
本题难度:简单
3、选择题 向蒸馏水中加入一定量的NaHSO4晶体,保持常温,测得溶液的pH=4,下列说法正确的是
[? ]
A.水电离出的H+的浓度是1.0×10-4 mol.L-1
B.溶液中粒子浓度:c(Na+) =c(HSO3-) +2c(SO32-)+c(H2SO4)
C.溶液中粒子浓度:c(H+) +c(HSO3-) +2c(H2SO3) =c(OH-)
D.溶液中粒子浓度:c( HSO3-)>c(SO32-)>c(H2SO4)
参考答案:D
本题解析:
本题难度:一般
4、填空题 (1)大气中SO2含量过高会导致雨水中含有(填化学式)__________而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为____________。
(2)已知NaHSO3的水溶液显酸性,比较其中SO32- 、HSO3-、H2SO3三种粒子的浓度,最大的是_________,最小的是_____________。
(3)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为__________mol。
(4)已知25℃时,Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9。下列说法不正确的是__________。
A.25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变
B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3
C.向Na2SO4溶液中加入过量BaCl2溶液后,溶液中c(SO42- )降低为零
参考答案:(1)H2SO4、H2SO3? ;SO2+Na2SO3+H2O=2NaHSO3
(2) HSO3-? ;H2SO3
(3)0. 05
(4) BC
本题解析:
本题难度:一般
5、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是
[? ]
 )> c(
)> c( )?> c(H2CO3)
)?> c(H2CO3) 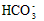 ) + c(H2CO3)
) + c(H2CO3) 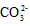 )?>c(
)?>c(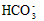 )?>c(OH-)?>c(H+)
)?>c(OH-)?>c(H+)参考答案:D
本题解析:
本题难度:一般