时间:2018-03-17 06:58:10
1、选择题 下列递变规律正确的是
A.热稳定性:HCl >HF >H2O
B.沸点:金刚石>冰>干冰
C.碱性:NaOH >Mg(OH)2>Ca(OH)2
D.元素的最高正化合价:F>S>C
参考答案:B
本题解析:非金属性越强,氢化物的稳定性越强,A不正确,应该是HF >H2O> HCl 。金刚石是原子晶体,冰和干冰是分子晶体,水中含有氢键,所以沸点高于干冰的,B正确。金属性越强,最高价氧化物的水化物的碱性越强,C中应该是Ca(OH)2>NaOH >Mg(OH)2。F是最强的非金属,没有正价,D不正确,所以答案选B。
本题难度:简单
2、选择题 下列原子或离子原子核外电子排布不属于基态排布的是
A.N: 1s22s22p3
B.S2-: 1s22s22p63s23p6
C.Na: 1s22s22p53s2
D.Si: 1s22s22p63s23p2
参考答案:C
本题解析:试题分析:基态电子排布是根据构造原理电子从能量低的轨道一次进入能量高的轨道的排布。这样使整个原子处于能量最低状态。C中Na原子的2p轨道还没有排满就去排3s轨道,所以不是能量最低状态,不是基态电子排布。所以答案选C。考点:核外电子排布点评:从构造原理图中可以看出能级的能量高低除了符合E(ns)<E(np)<E(nd)<E(nf)和E(1s)<E(2s)<E(3s)<E(4s)等规律之外,还存在一些不同能层的能级的交错现象。例如,E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
本题难度:一般
3、选择题 对碱金属元素,随着核电荷数的增大,下列说法不正确的是
A.原子半径依次增大
B.单质的熔沸点依次降低
C.氧化物对应的水化物碱性依次增强
D.单质的还原性依次减弱
参考答案:D
本题解析:同一主族的金属元素自上而下,原子半径依次增大,熔沸点降低,对应碱的碱性增强,单质的还原性(表现为金属性)应增强.
本题难度:简单
4、选择题 下列关于物质性质变化的比较,不正确的是( )
A.酸性强弱:HI>HBr>HCl>HF
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.还原性强弱:F->Cl->I-
参考答案:A、第ⅤⅡA主族元素从上到下氢化物稳定性减弱,溶于水形成酸的酸性从上到下增强,即酸性强弱为HI>HBr>HCl>HF,故A正确;
B、同周期从左到右原子半径一次减小,Na、S、O三种原子的半径大小为Na>S>O,故B正确;
C、第ⅠA主族金属形成的最高价氢氧化物碱性依次增强,KOH>NaOH>LiOH,故C正确;
D、第ⅤⅡA主族元素单质的氧化性从上到下依次减弱,对应阴离子的还原性依次增强,故D错误;
故选D.
本题解析:
本题难度:一般
5、推断题 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A,D同主族,C与E同主族,D、
E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素原子,原子半径最大的是___________(填元素符号)
(2)A、C、D三种兀素组成的一种常见化合物是重要的工业产品,该化合物的电子式为__________;
(3)B与F两种元素形成的一种化合物分子, 各原子均达8电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是__________;
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为____________________
参考答案:(1)Na
(2)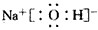
(3)HClO和NH3(NH3·H2O)
(4)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
本题解析:
本题难度:一般