时间:2018-03-17 06:47:53
1、填空题 现有浓度均为0.1 mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵⑤硫酸铝 ⑥碳酸氢钠。请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是____________(填序号)。
(2)已知T℃,Kw = 1×10-13,则T℃ ________(填“>”、“<”、“=”)25℃。在T℃时,将pH = 11的③溶液a L与pH = 1的①溶液b L混合(忽略混合后溶液体积的变化),若所得溶液的pH = 10,则a:b = ___________。
(3)将⑤溶液和⑥溶液混合时,可看到的实验现象是_________,产生该现象的原因是____________(用离子方程式解释原因)。
参考答案:(1)④②③①
(2)> ;?11:9
(3)产生白色沉淀,同时放出无色无味气体; Al3++3HCO3-=Al(OH)3↓+3CO2↑
本题解析:
本题难度:一般
2、选择题 常温下某溶液中由水电离产生的[H+]=1×10-5 mol·L-1,则下列叙述正确的是
A.PH值为5
B.一定是酸溶液
C.可能是强酸的酸式盐溶液
D.PH值可能为9
参考答案:D
本题解析:
本题难度:简单
3、选择题 室温下,取0.2mol/L H2 A溶液与xmol/L NaOH溶液等体积混合(忽略混合后溶液体积变化),测得混合溶液的pH=y,下列推断不正确的是
A.当x=0.2,则混合溶液中y可能大于7或小于7
B.当x=0.2,y=1,则混合溶液中:c(H+)=c(A-)+c(OH-)
C.当x=0.3,y>7,则混合溶液中:c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D.当x=0.4,则混合溶液中:[c(Na+)+c(H+)]>2c(A2-)
参考答案:C
本题解析:A.当x=0.2,则混合后二者恰好完全反应产生NaHA。若NaHA是强酸的酸式盐或是弱酸的酸式盐,HA-的电离大于其水解作用,则溶液显酸性,y小于7,若NaHA是弱酸的酸式盐,HA-的水解大于其电离作用,则溶液显碱性,y大于7,正确;B.当x=0.2,y=1,反应产生NaHA ,c(NaHA)=0.1mol/L。由于y=1,即c(H+)=0.1mol/L,NaHA是强酸的酸式盐,则根据物料守恒可得混合溶液中:c(H+)= c(A-) +c(OH-),正确;C.当x=0.3,则反应产生的是NaHA、Na2A等浓度的混合溶液。y>7,则混合溶液中离子浓度关系是c(Na+) >c(HA-)>c(A2-)> c(OH-)>c(H+),错误;D。当x=0.4,反应反应产生Na2A。则根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+ c(HA-)+ 2c(A2-)。全部大于部分的和,因此混合溶液中:[c(Na+)+ c(H+)]>2c(A2-),正确。
考点:考查酸碱混合溶液中离子的浓度大小比较的知识。
本题难度:一般
4、选择题 水的电离过程为H2O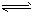 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014,
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×1014,
K(35℃)=2.1×10 -14。则下列叙述正确的是
[? ]
参考答案:D
本题解析:
本题难度:一般
5、选择题 某Na2CO3溶液的pH可能是
A.5
B.6
C.7
D.8
参考答案:D
本题解析:碳酸钠是强碱弱酸盐,水解溶液显碱性,pH大于7,答案选D。
考点:考查盐类水解的应用、溶液酸碱性的判断
点评:该题是基础性试题的考查,试题注重基础,侧重对学生基础性知识的巩固与训练。该题的关键是明确盐类水解含义,盐类水解的条件以及溶液酸碱性的判断,难度不大。
本题难度:一般