时间:2018-03-17 06:47:53
1、选择题 12.有甲、乙两醋酸稀溶液,测得甲的pH=2,乙的pH=3。下列推断中正确的是
A.物质的量浓度c(甲)=10c(乙)
B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)=10V(甲)
D.甲中的c(OH-)为乙中c(OH-)的1/10倍
参考答案:BD
本题解析:A项如果醋酸的电离程度相等,则物质的量浓度c(甲)=10c(乙),实际上乙的电离程度大于甲,所以c(甲)>10c(乙);B项甲中水电离出的氢离子=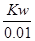 mol/L,乙中水电离出的氢离子浓度=
mol/L,乙中水电离出的氢离子浓度=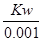 mol/L,所以甲中由水电离产生的H+的物质的量浓度是乙的0.1倍;C项因为c(甲)>10c(乙),所以中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲);D项甲中氢氧根离子浓度=
mol/L,所以甲中由水电离产生的H+的物质的量浓度是乙的0.1倍;C项因为c(甲)>10c(乙),所以中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)>10V(甲);D项甲中氢氧根离子浓度=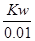 mol/L,乙中氢氧根离子浓度=
mol/L,乙中氢氧根离子浓度=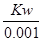 mol/L,所以甲氢氧根离子浓度是乙的0.1倍。
mol/L,所以甲氢氧根离子浓度是乙的0.1倍。
考点:弱电解质在水溶液中的电离平衡;pH的定义
点评:本题考查了弱电解质的电离,明确弱电解质溶液的浓稀与其电离程度之间的关系是解答本题的关键。
本题难度:一般
2、选择题 下列电离方程式错误的是
[? ]
A.CaCl2=Ca2++2Cl-
B.Na2SO4=2Na++SO42-
C.HNO3=H++NO3-
D.KClO3=K++Cl-+3O2-
参考答案:D
本题解析:
本题难度:简单
3、填空题 (8分) 常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略体积的变化),测得混合溶液的pH=9。试回答以下问题:
(1)液的pH=9的原因是_________________________(用离子方程式表示);
(2)混合后的溶液中由水电离出的c(OH-)为a,pH=9 的NaOH溶液中由水电离出的c(OH-)为b,则a b(填“>”、“<”或“=”),a
参考答案:
本题解析:
本题难度:简单
4、选择题 已知25 ℃时,下列酸的电离常数:醋酸:1.75×10-5氢氰酸:4.93×10-10
氢氟酸:7.2×10-4甲酸:1.77×10-4则物质的量浓度均为0.1 mol·L-1的上述溶液酸性最强的是 ( )
A 醋酸 B 氢氰酸 C氢氟酸 D甲酸
参考答案:C
本题解析:
正确答案:C
浓度相同时,组成相似的酸,电离常数越大,酸性越强,氢氟酸:7.2×10-4,酸性最强。
本题难度:简单
5、选择题 现有浓度为1mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl ⑤NaOH,由水电离出的C(H+)大小关系正确的是
[? ]
A.④>③>①=⑤>②
B.①=②>③>④>⑤
C.②>①>③>④>⑤
D.④>③>①>⑤>②
参考答案:A
本题解析:
本题难度:一般