时间:2018-03-17 06:47:53
1、选择题 下列说法正确的是
A.HCl溶液中无OH-
B.NaOH溶液中无H+
C.NaCl溶液中既无OH-也无H+
D.常温下,任何物质的水溶液中都有H+和OH-,且KW=1×10-14
参考答案:D
本题解析:由于水的电离平衡H2O
本题难度:一般
2、计算题 (6分)(1)常温下100mL0.05 mol·L-1的氢氧化钡溶液中滴加硫酸钠溶液,当两者恰好完全反应时,测得溶液的pH为12。则加入硫酸钠溶液的体积是____________ ml。(溶液混合时体积的变化不计,下同)
(2)常温下,若100体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的PH(用a表示)与强碱的PH(用b表示)之间应满足的关系是 。
(3)已知100℃ KW=1×10-12 ,0.1mol/LNaOH溶液,由水电离出的OH-物质的量的浓度为 ,PH= 。
参考答案:(6分)(1)900。(2) a+b="16" 。(3) 1.0×10-11mol/L,11
本题解析:(1)由题意知,原溶液的pH=13,加入硫酸钠溶液后pH=12,即相当于稀释为原先溶液体积的10倍,所以加入溶液体积为900ml
(2)代入公式:a+b=14+lg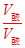 =16
=16
(3)0.1mol/LNaOH溶液中,H+全部来自于水的电离;所以c(H+)=10-12/0.1=10-11,所以由水电离出的OH-物质的量的浓度为1.0×10-11mol/L,pH即为11
本题难度:困难
3、选择题 某物质溶液的pH=3,若加水稀释使溶液体积变为原来的10倍,所得溶液的pH: 3<pH<4,则该物质可能是 ( )
A.H2S
B.HCl
C.CH3COONa
D.NH4Cl
参考答案:AD
本题解析:
正确答案:AD
pH=3,若加水稀释使溶液体积变为原来的10倍,所得溶液的pH: 3<pH<4,说明该溶液是弱酸或弱酸性物质,H2S,NH4Cl符合题意。B、稀释后pH=4;C、呈碱性。
本题难度:一般
4、选择题 下列电离方程式正确的是( )
A.NaHCO3(溶液):NaHCO3=Na++H++CO32-
B.NaHSO4(熔融):NaHSO4=Na++H++SO42-
C.(NH4)2SO4(溶液):(NH4)2SO4=(NH4)2++SO42-
D.NH3?H2O(溶液):NH3?H2O?NH4++OH-
参考答案:D
本题解析:
本题难度:简单
5、选择题 在其他条件不变时,纯净水中加入下列物质,不会影响水的电离平衡的是( )
A.FeCl3
B.NaOH
C.H2SO4
D.NaNO3
参考答案:D
本题解析:
本题难度:一般