时间:2018-03-17 06:14:56
1、选择题 用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
[? ]
A.白醋中滴入石蕊试液呈红色
B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出
D.pH试纸显示醋酸的pH为2~3
参考答案:D
本题解析:
本题难度:一般
2、选择题 在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的H2,下列说法正确的是
[? ]
A.甲烧杯中放入锌的质量比乙烧杯中放入的锌质量小
B.甲烧杯中的酸过量
C.两烧杯中参加反应的锌量相等
D.反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小
参考答案:C
本题解析:
本题难度:一般
3、选择题 已知下表为250C时某些弱酸的电离平衡常数。下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。依据所给信息,下列说法正确的是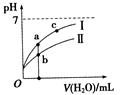
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7?Ka2=4.7×10-11 |
参考答案:C
本题解析:A、醋酸的酸性强于次氯酸,所以相同浓度的CH3COONa和NaClO的混合溶液中,水解程度CH3COO-< ClO—,溶液中离子浓度的大小关系是C(Na+)>C(CH3COO—) >C(ClO—) >C(OH—)>C(H+),错误;B、由所给电离平衡常数可知酸性H2CO3> HClO> HCO3-,所以向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO—+CO2+H2O=HClO+HCO3—,错误;C、a、b、c三点所示溶液中氢离子浓度的大小关系是b>a>c,氢离子浓度越大,使水的电离平衡逆向移动,水的电离程度越小,所以水的电离程度c>a>b,正确;D、醋酸的酸性比次氯酸强,所以加入相同体积的水时醋酸的pH小于次氯酸,所以Ⅰ表示HClO,Ⅱ表示CH3COOH,溶液的导电性与溶液中的离子浓度有关,离子浓度越大,导电性越强,所以溶液导电性: b>a>c,错误,答案选C,
本题难度:一般
4、填空题 某二元酸(化学式用H2B表示)在水中的电离方程式是H2B=H++HB-;HB-?H++B2-。回答下列问题。
(1)Na2B溶液显________(填“酸性”、“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能________0.11 mol·L-1(填“<”、“>”或“=”),理由是_________________________________________________________________。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_____________。
参考答案:(1)碱性 B2-+H2O  ?HB-+OH- (2)CD
?HB-+OH- (2)CD
(3)< 0.1 mol·L-1NaHB溶液的pH=2,说明其中c(H+)=0.01 mol·L-1,主要是HB-电离产生的,在H2B溶液中,第一步电离产生的H+抑制了第二步的电离,所以0.1 mol·L-1 H2B溶液中c(H+)<0.11 mol·L-1
(4)c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)
本题解析:(1)由H2B=H++HB-(完全电离),HB-?H++B2-(部分电离),知Na2B溶液中B2-将发生水解反应,故Na2B溶液显碱性,原因是B2-+H2O?HB-+OH-。
(2)在Na2B溶液中存在:Na2B=2Na++B2-,B2-+H2O  ?HB-+OH-,H2O
?HB-+OH-,H2O  ?H++OH-。由电荷守恒知c(Na+)+c(H+)=2c(B2-)+c(OH-)+c(HB-),C对。由物料守恒知c(Na+)=2c(B2-)+2c(HB-)=0.2 mol·L-1,D对。在Na2B溶液中不存在H2B,A错,由物料守恒和电荷守恒知B错。(3)在NaHB溶液中,NaHB=Na++HB-,HB-
?H++OH-。由电荷守恒知c(Na+)+c(H+)=2c(B2-)+c(OH-)+c(HB-),C对。由物料守恒知c(Na+)=2c(B2-)+2c(HB-)=0.2 mol·L-1,D对。在Na2B溶液中不存在H2B,A错,由物料守恒和电荷守恒知B错。(3)在NaHB溶液中,NaHB=Na++HB-,HB-  ?H++B2-,H2O
?H++B2-,H2O  ?
?
H++OH-。已知0.1 mol·L-1 NaHB溶液的pH=2,说明其中c(H+)=0.01 mol·
L-1,主要是HB-电离产生的。在H2B溶液中,第一步电离产生的H+抑制了第二步的电离,所以0.1 mol·L-1H2B溶液中c(H+)<0.11 mol·L-1。(4)在NaHB溶液中各离子浓度大小顺序为c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-)。
本题难度:一般
5、选择题 将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各示意图混合溶液有关量或性质的变化趋势,其中错误的是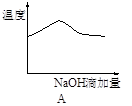
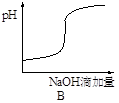
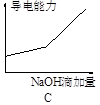
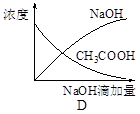
参考答案:D
本题解析:A.酸碱中和反应是放热反应,所以随着碱的滴入,反应产生的热量是溶液的温度升高,当醋酸完全反应后再滴加的NaOH会吸收反应产生的热量,是溶液的温度又逐渐降低,正确;B.向醋酸溶液中滴加NaOH溶液,由于开始时醋酸多,NaOH少量,所以溶液的pH不会变化很大,当二者接近恰好完全反应时,溶液的酸碱性会发生很大的变化,即发生突越,后随着NaOH的加入,溶液的碱性增强;所以溶液的pH也会逐渐增大,正确;C.向醋酸溶液中加入NaOH溶液,发生酸碱中和反应,产生醋酸钠和水,醋酸钠是可溶性强电解质,溶液中自由移动的离子浓度增大,溶液的导电性逐渐增强;在前一段是酸碱中和反应,后一段是醋酸钠与过量的NaOH混合溶液电离产生的离子的导电,因此导电性要比原来的强,正确;D.向醋酸溶液中加入NaOH溶液,二者发生反应产生醋酸钠和水,所以醋酸的物质的量逐渐减小,而NaOH在二者恰好反应前是不存在的,只有当NaOH过量时,才会随着NaOH的增多,浓度逐渐增大,错误。
考点:考查醋酸与NaOH发生反应时溶液的温度、酸碱性、导电能力及物质的物质的量浓度的变化的知识。
本题难度:一般