时间:2018-03-17 05:57:21
1、选择题 J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表.已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素.下列说法错误的是( )
A.J和氢组成的化合物分子有多种
B.工业上不用电解M和T组成的化合物来制备M
C.R、T两元素的气态氢化物中,R的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4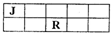
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是( )
A.非金属原子间以共价键结合的物质都是共价化合物
B.含有共价键的化合物都是共价化合物
C.凡是能电离出离子的化合物都是离子化合物
D.凡是含有离子键的化合物都是离子化合物
参考答案:D
本题解析:
本题难度:一般
3、填空题 核能源已日益成为当今世界的主要能源。
(1)核能原料UO2可通过三碳酸铀酰铵(NH4)4[UO2(CO3)3]直接煅烧还原制得。UO2晶体属CaF2型面心立方结构(CaF2的晶胞示意图如图),则UO2晶体U4+的配位数为?;三碳酸铀酰铵中含有化学键类型有?;
A.离子键
B.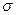
 键
键
C. 键
键
D.氢键 E.配位键
根据价层电子对互斥理论推测CO32—的空间构型为?;写出一种与CO32—互为等电子体且属于非极性分子的微粒的化学式?。
(2)为了获得高浓度235U,科学家们采用“气体扩散法”;到目前为止,UF6是唯一合适的化合物。UF6在常温常压下是固体,在56.4℃即升华成气体。UF6属于?晶体。
(3)放射性碘是重要的核裂变产物之一,因此放射性碘可以为核爆炸或核反应堆泄漏事故的信号核素。写出131I基态原子的价电子排布式?。
参考答案:
本题解析:略
本题难度:一般
4、选择题 氢元素与其他元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是
[? ]
A.一个D2O分子所含的中子数为8
B.NH3的结构式为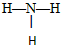
C.HCl的电子式为
D.热稳定性:H2S>HF
参考答案:B
本题解析:
本题难度:简单
5、实验题 在下图中,横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的量:
从A~D中选择符合表中各项要求填入相应位置。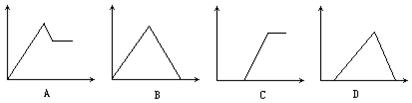

参考答案:BCDAC</PGN0098B.TXT/PGN>
本题解析:①饱和石灰水中通入二氧化碳,立即生成沉淀,当通入过量二氧化碳时,沉淀逐渐溶解,当通入二氧化碳跟原溶液中氢氧化钙的物质的量比为2∶1时,沉淀完全溶解,反应的化学方程式是:
Ca(OH)2+CO2====CaCO3↓+H2O
CaCO3+CO2+H2O====Ca(HCO3)2
②二氧化碳通入含氢氧化钠的偏铝酸钠溶液中,首先跟氢氧化钠反应,没有沉淀生成:
2NaOH+CO2====Na2CO3+H2O
把氢氧化钠都中和完以后,接着二氧化碳跟偏铝酸钠反应:
NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3
当偏铝酸钠反应完以后,再通入二氧化碳,沉淀不再增加,但是也不会溶解。
③稀盐酸加到含氢氧化钠的偏铝酸钠溶液中时,首先中和氢氧化钠,没有沉淀生成:
NaOH+HCl====NaCl+H2O
然后盐酸跟偏铝酸钠反应,生成沉淀,加入过量的盐酸时,生成的氢氧化铝沉淀又溶解于盐酸中:
NaAlO2+HCl+H2O====Al(OH)3↓+NaCl
Al(OH)3+3HCl====AlCl3+3H2O
④氢氧化钠逐滴加到氯化镁和氯化铝的混合溶液中,观察到有白色沉淀生成,沉淀逐渐增加:
MgCl2+2NaOH====Mg(OH)2↓+2NaCl
AlCl3+3NaOH====Al(OH)3↓+3NaCl
当溶液中的Mg2+、Al3+都用完时,沉淀量最大,再加过量的氢氧化钠溶液,沉淀开始减少,到氢氧化铝全部溶解时,沉淀的量不再减少:
Al(OH)3+NaOH====NaAlO2+2H2O
⑤三氯化铝溶液逐滴加氢氧化钠溶液时,先观察到有白色沉淀,由于氢氧化钠过量,振荡,沉淀溶解,直至氢氧化钠消耗尽:
AlCl3+3NaOH====Al(OH)3↓+3NaCl
Al(OH)3+NaOH====NaAlO2+2H2O
继续滴加三氯化铝,有白色沉淀生成,沉淀量不断增加,当溶液中AlO2-离子消耗尽以后,再加三氯化铝,沉淀的量不变。
3NaAlO2+AlCl3+6H2O====4Al(OH)3↓
本题难度:一般