时间:2018-03-17 05:57:21
1、选择题 共价键、离子键、金属键、分子间作用力都是微粒间的作用力,下列物质只含有以上一种作用力的是
[? ]
A.H2?
B.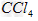 ?
?
C.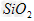 ?
?
D.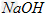 ?
?
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列关于化学键的说法中正确的是
[? ]
A.金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性
B.配位键常用A→B表示,其中A原子可以提供接受孤电子对的空轨道
C.含有π键的分子在反应时,π键是化学反应的积极参与者
D.金属元素原子和非金属元素原子间只能形成离子键
参考答案:C
本题解析:
本题难度:简单
3、填空题 已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为________。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为______。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为________
在该晶体中,E4+的氧配为数为____________。若该晶胞边长为a nm可 计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)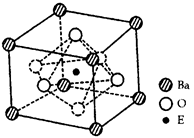
参考答案:
(1)Na<S<P<Cl
(2)三角锥形? sp3
(3)? 3d64s2?N2?2
(4)TiO2+BaCO3 BaTiO3+CO2↑ ;? 6 ;? 233/[NA×(a×10-7)3]
BaTiO3+CO2↑ ;? 6 ;? 233/[NA×(a×10-7)3]
本题解析:(1)B原子的p轨道半充满,则若的电子排布式为1s22s22p3. B为N元素。对于氢化物来说。结构相似的物质,相对分子质量越大,分子间作用力就越大,物质的熔沸点就越高。而HF、H2O、NH3的分子之间除了存在分子间作用力外,还存在一种叫氢键的作用力,增大了分子间的相互作用,使它们的熔沸点在同族元素形成的氢化物中最高,出现反常现象。NH3的沸点在同族中是最高的,不符合题意。舍弃。则电子排布式是1s22s22p63s23p3,B元素为P元素。又因为其氢化物沸点是同族元素中最低的符合题意;因此B元素为P元素。D原子得到一个电子后3p轨道全充满,则D的电子排布式为1s22s22p63s23p5. D为Cl.元素。A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,则A、C在元素周期表中位于同一周期,结合化合物的及它们的原子序数都比Cl小等知识可确定A为Na元素,C为S元素。E4+离子和氩原子的核外电子排布相同,则E为22号元素Ti元素。A、B、C、D、E、F的原子序数之和为107,所以F的原子序数为:107-11-15-16-17-22=26,F是Fe元素。(1)对于电子层数越多的元素,原子核外的电子数越多,原子半径越小,原子失去电子就越难,即电离能就越大。所以Na、P、S、Cl的第一电离能由小到大的顺序是Na<S<P<Cl。(2在化合物PCl3的分子中,每个P原子与三个Cl原子形成三个共价键,在P原子上还有一对孤对电子。所以PCl3的分子空间构型可描述为三角锥形. P原子的杂化方式为sp3。(3)Fe原子的基态原子的电子排布式为1s22s22p63s23p63d64s2,则基态Fe的价电子排布式为3d64s2。电子数相同、原子数也相同的微粒就叫做等电子体。CN-的电子数为14,原子数为2,所以与CN-互为等电子体的分子为N2。等电子体结构相似,性质也相似。由于在N2中2个N原子共用三对电子,一个是?键,2个π键。所以在CN-中的π键也是2个。(4)由晶胞的结构示意图结合均摊法可知:在每个晶胞中含有:Ti:1;? Ba:8×1/8=1;? O:6×1/2=3.所以该化合物的化学式为BaTiO3。故TiO2与碳酸钡在熔融状态下反应的化学方程式为TiO2+BaCO3 BaTiO3+CO2↑。在晶体中每个Ti原子周围有6个O原子与它距离相等而且最近,这6个O原子构成的是正八面体。所以配位数为6.由于在一个晶胞中只含有一个BaTiO3。所以晶体的密度
BaTiO3+CO2↑。在晶体中每个Ti原子周围有6个O原子与它距离相等而且最近,这6个O原子构成的是正八面体。所以配位数为6.由于在一个晶胞中只含有一个BaTiO3。所以晶体的密度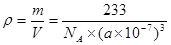 。
。
本题难度:困难
4、选择题
下列化合物中既存在离子键,又存在极性键的是 (? )





 ?
?
A.H2O
B.NH4Cl
C.NaOH
D.Na2O2
参考答案:
答案:B C
本题解析:
水分子中只有H-O键,是极性键,无离子键,排除A项;NH4Cl中NH4+和Cl-间是离子键,NH4+内N和H原子以极性键结合,B项正确;NaOH中Na+和OH-以离子键结合,OH-内H和O之间以极性键结合,C项正确;Na2O2中Na+和O22-以离子键结合,O22-内有非极性键,排除D项。
本题难度:一般
5、选择题 下列分子中,只有σ键而没有π键的是
[? ]
A.CH4
B.CH3CH3
C.CH2=CH2
D.CH≡CH
参考答案:AB
本题解析:
本题难度:简单