时间:2018-03-17 05:54:38
1、选择题 常温条件下列溶液中离子浓度的等量关系正确的是(?)
A.0.1 mol/L氨水中:c(NH4+) + c(H+) = c(OH-)
B.0.1 mol/L的NH4Cl溶液中:c(NH4+) = c(Cl-)
C.同为0.1 mol/L的硫酸和氨水等体积混合后:c(NH4+) + 2c(NH3·H2O) = 2c(SO42-)
D.pH=3的盐酸和pH=11的氨水等体积混合后:c(OH-) = c(H+)
参考答案:A
本题解析:根据电荷守恒可知A正确。NH4Cl溶液中,由于NH4+水解,使其浓度小于c(Cl-),B不正确。同为0.1 mol/L的硫酸和氨水等体积混合后,生成物是NH4HSO4,根据物料守恒可知c(NH4+) + c(NH3·H2O) =c(SO42-),C不正确。pH=11的氨水其浓度大于0.001mol·L-1,所以在等体积放热情况下和盐酸反应,氨水过量,溶液显碱性,答案是A。
本题难度:一般
2、选择题 在KCl、FeCl3、Fe2(SO4)3三种盐配成的混合溶液中,若K+为0.15 mol,Fe3+为0.25 mol,Cl-为0.2 mol,则SO42-为
A.0.1 mol
B.0.15 mol
C.0.25 mol
D.0.35 mol
参考答案:D
本题解析:由于溶液是显电中性的,则有0.15mol+0.25mmol×3=0.2mol+2x,解得x=0.35mol,答案选D。
点评:该题是中等难度的试题,侧重对学生灵活运用基础知识解决实际问题的能力的培养。该题的关键是利用好电荷守恒定律,然后结合题意灵活运用即可。
本题难度:简单
3、选择题 已知一种c(H+)=1×10—3mol/L的酸溶液和一种c(OH—)=1×10—3mol/L的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.碱过量,没有全部参加反应
B.等浓度的一元强酸和一元弱碱溶液反应
C.等浓度的一元弱酸和一元强碱混合
D.浓的弱酸和稀的强碱溶液反应
参考答案:D
本题解析:c(H+)=1×10—3mol/L的酸溶液和一种c(OH—)=1×10—3mol/L的碱溶液等体积混合后溶液呈酸性,即可得该酸为弱酸,酸过量导致溶液显酸性,所以,正确选项为D;
本题难度:简单
4、选择题 一些烷烃的燃烧热如下表:下列表达正确的是( )
| 烷烃 | 燃烧热/kJ?mol-1 | 烷烃 | 燃烧热/kJ?mol-1 甲烷 891.0 正丁烷 2878.0 乙烷 1560.8 异丁烷 2869.6 丙烷 2221.5 异戊烷 3531.3 |
参考答案:A、正戊烷和2-甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,则互为同分异构体的化合物,支链多的燃烧热小,则正丁烷的燃烧热大于2-甲基丁烷,
即正戊烷的燃烧热大约在3540KJ/mol左右,且大于3531.3KJ/mol,故A错误;
B、由表格中的数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷的能量低,即热稳定性为正丁烷<异丁烷,故B错误;
C、根据乙烷燃烧热的含义:完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量,所以热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l);△H=-3121.6kJ/mol,故C错误;
D、相同物质的量的烷烃,碳的物质的量分数越大,燃烧放热越多,即n越大,燃烧放出的热量越多,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 已知氢气和碳的燃烧的热化学方程式为
①2H2(g)+O2(g)==2H2O(l) △H1=-a kJ·mol-1
②H2(g)+1/2O2(g)==H2O(g) △H2=-b kJ·mol-1
③C(s)+1/2O2(g)==CO(g) △H3=-c kJ·mol-1
④C(s)+O2(g)==CO2(g) △H4=-d kJ·mol-1
那么,下列说法正确的是
[? ]
A.氢气的燃烧热为a kJ·mol-1
B.碳的燃烧热为d kJ·mol-1
C.一氧化碳的燃烧热为-(d-c)kJ·mol-1
D.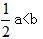
参考答案:B
本题解析:
本题难度:简单