时间:2018-03-17 05:54:13
1、选择题 下列说法或表示方法中正确的是?
[? ]
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)→C(石墨);ΔH?=?-11.9?kJ/mol?可知,金刚石比石墨稳定
C.在101kPa时,2g?H2完全燃烧生成液态水,放出285.8?kJ热量,氢气燃烧的热化学方程式为:2H2(g)?+?O2(g)?=?2H2O?(l);ΔH?=?+285.8?kJ/mol
D.稀溶液中:H+(aq)+OH-(aq)?=?H2O?(l);ΔH?=?-53.7kJ/mol?,若将含0.5?molH2SO4的浓溶液与含1?mol?NaOH的溶液混合,放出的热量大于53.7?kJ
参考答案:D
本题解析:
本题难度:一般
2、填空题 (共7分)工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;请回答下列问题:
CH3OH(g)。图1表示反应中的能量变化;请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H = 。
CH3OH(g)的△H = 。
(2)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH =-193kJ/mol,又知H2O(l)= H2O(g) ΔH =+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
参考答案:(1)b —91KJ/mol
(2)CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-281kJ/mol
本题解析:(1) 催化剂降低反应的活化能,所以b使用了催化剂;△H =生成物的总能量—反应物的总能量="—91" kJ/mol;(2) ①CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)ΔH =-193kJ/mol,②H2O(l)= H2O(g) ΔH =+44 kJ/mol,根据盖斯定律,①-②×2得:CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-281kJ/mol。
考点:本题考查反应热。
本题难度:一般
3、选择题 相同温度下,有下列三个热化学方程式
(1)H2(g)+1/2O2(g)=== H2O(g) △H1= -Q1kJ·mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2kJ·mol-1
(3)2H2(g)+O2(g)=== 2H2O(g) △H1= -Q3kJ·mol-1
则Q1、Q2、Q3的关系表示正确的是
[? ]
A.Q1=Q2<
B.Q2>Q3>Q1
C.Q3>Q2>Q1
D.Q1=Q2=Q3
参考答案:B
本题解析:
本题难度:一般
4、填空题 (1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH="-129.0" kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置实现上述过程: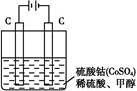
①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极反应式: 。
(4)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图: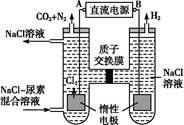
①电源的负极为 (填“A”或“B”)。
②阳极室中发生的反应依次为 。
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g (忽略气体的溶解)。
参考答案:(1)CH4(g)+H2O(g)=CH3OH (g)+H2(g) ΔH="+77.0" kJ·mol-1
(2)①Co2+-e-=Co3+
②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
(3) Al-3e-+3HC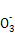 =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑
(4)①B ②2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=CO2+N2+6HCl
③不变 7.2
本题解析:(1)Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH="-129.0" kJ·mol-1
Ⅰ+Ⅱ得:CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1
(2)根据反应原理,通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化,则通电时Co2+失电子,阳极的电极反应式为Co2+-e-=Co3+。除去甲醇的离子方程式6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
(3)Al—空气原电池铝作负极,失电子生成铝离子,和碳酸氢钠反应生成氢氧化铝和二氧化碳。负极:Al-3e-+3HC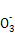 =Al(OH)3↓+3CO2↑。
=Al(OH)3↓+3CO2↑。
(4)①由图可知产生Cl2的电极为阳极,故A为正极,B为负极。②阳极室发生的反应首先为2Cl--2e-=Cl2↑。由产物CO2、N2可知CO(NH2)2在此室被氧化,Cl2被还原,故反应为CO (NH2)2+3Cl2+H2O=CO2+N2+6HCl。③阴极发生2H++2e-=H2↑,同时阳极室HCl电离出的H+通过质子交换膜进入阴极室,从而使阴极室H+浓度保持不变,即pH与电解前相比不变。两极共收集到的气体n(气体)=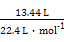 ="0.6" mol,由:
="0.6" mol,由:
CO(NH2)2~3Cl2~3H2~CO2~N2
60 g 5 mol
m[CO(NH2)2] 0.6 mol
得:m[CO(NH2)2]=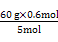 ="7.2" g。
="7.2" g。
本题难度:一般
5、填空题 (14分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g) CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。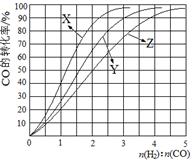
230℃的实验结果所对应的曲线是 (填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是 (填字母) 。
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。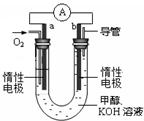
①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
参考答案:(每空2分,共14分)(1)CH3OH(l)+ O2(g) = CO(g) + 2H2O(l) ΔH=—443.5 kJ
本题解析:
本题难度:困难