时间:2018-03-17 05:41:31
1、填空题 (8分)已知有以下物质相互转化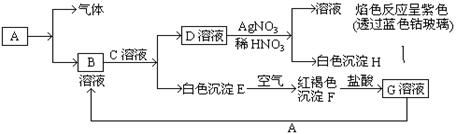
试回答:(1)写出B的化学式?,D的化学式?。
(2)写出由E转变成F的化学方程式?。
(3)写出F转化成G的离子方程式?;
参考答案:FeCl2? KCl? 4Fe(OH)2+O2+2H2O=4Fe(OH)3? Fe(OH)3+3H+==Fe3++3H2O
本题解析:根据D溶液与AgNO3溶液反应生成不溶于硝酸的白色沉淀H,因此H是AgCl。同时得到的溶液的焰色反应为紫色,说明D是KCl。根据白色沉淀E遇到空气变成红褐色沉淀F,可知E为Fe(OH)2,F为Fe(OH)3,G为FeCl3。根据B溶液和C溶液可以生成Fe(OH)2和KCl溶液,则B为FeCl3,C为KOH,A为Fe。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
2、填空题 实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: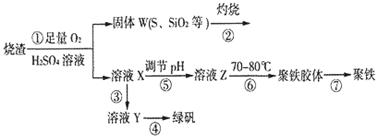
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是__________;
A.品红溶液? B.紫色石蕊溶液?C.酸性KMnO4溶液? D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为:___________________________________。
(3)过程③中,需加入的物质是___________________________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有_______________。
(5)过程⑤调节pH可选用下列试剂中的___________ (填选项序号);
A.稀硫酸? B.CaCO3? C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是_____________________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.70g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为___________。(假设杂质中不含铁元素和硫元素)。
参考答案:(1)ACD (2)4FeS + 3O2 + 6H2SO4 =?2Fe2(SO4)3?+ 6H2O+4S (3)Fe(或铁)
(4)蒸发皿、玻璃棒?(5)C ?(6)促进Fe3+的水解?(7)31.11%
本题解析:(1)固体W中含有S在灼烧时会产生SO2气体。A.把SO2通入品红溶液?SO2有漂白性,能使品花溶液褪色。正确。B.SO2的水溶液显酸性,紫色石蕊溶液变为红色。错误。C.SO2有还原性,能被酸性KMnO4溶液氧化为硫酸,KMnO4则被还原为无色的MnSO4?.正确。?D.SO2有还原性,能被溴水氧化为硫酸,溴水被还原为无色的HBr。正确。因此选项为ACD。(2)根据电子守恒和质量守恒定律可得出过程①中,FeS和O2、H2SO4反应的化学方程式为:4FeS+3O2+ 6H2SO4 =?2Fe2(SO4)3?+6H2O + 4S。(3)在溶液X中含有Fe2(SO4)3?和H2SO4,而绿矾是硫酸亚铁晶体。所以过程③中,需加入的物质是还原剂Fe粉。(4) 经过还原Fe粉还原的Fe2(SO4)3?和H2SO4溶液为FeSO4.要从该溶液中得到绿矾,因为硫酸亚铁的溶解度受温度的影响变化较大,所以采用冷却热饱和溶液的方法制取。实验操作有蒸发、浓缩、冷却、结晶。在过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要蒸发皿、玻璃棒?。(5)过程⑤调节pH可选用下列试剂中的应该用碱,相比而言NaOH的溶解度大,杂质离子Na+比Ca2+容易除去。选项为C。(6) Fe2(SO4)3是强酸弱碱盐,水解产生Fe(OH)3胶体。盐的水解反应是吸热反应,在过程⑥中,将溶液Z加热到70一80℃,目的是为了促进Fe3+的水解?。(7)该聚铁在经过酸溶解后,加入过量的氯化钡溶液。得到的沉淀为Ba SO4。n(Ba SO4)= 3.495g÷233g/mol=0.015mol.所以n(Fe)=0.015mol.m(Fe)=0.015mol×56g/mol=0.84g。因此在在聚铁中Fe元素的含量为(0.84g÷2.70g) ×100% =33.11%。2的化学性质、方程式的书写、盐的水解、混合物的分离方法、元素的含量的计算的知识。
本题难度:一般
3、填空题 有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐。运用该原理生产铜和绿矾(FeSO4·7H2O)的流程如下: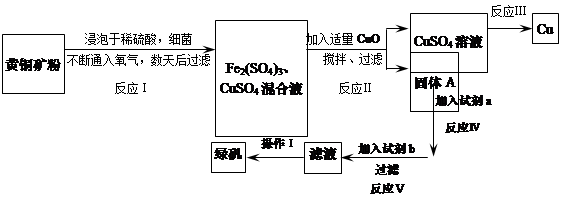
回答下列问题:
(1)已知:
| ? | Fe2+ | Cu2+ | Fe3+ |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
参考答案:(1)Fe3+在溶液中存在水解平衡,即Fe3++ 3H2O Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
(2)2CuSO4+2 H2O 2Cu+O2+2H2SO4.或Fe+CuSO4=Cu+FeSO4
2Cu+O2+2H2SO4.或Fe+CuSO4=Cu+FeSO4
(3) Fe;(4)结晶、过滤(5)4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O
本题解析:(1)Fe3+在溶液中存在水解平衡,即Fe3++ 3H2O Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
Fe(OH)3+3H+,在PH小于4时,Fe3+开始沉淀(PH=2.7),当加入氧化铜后,氧化铜能与H+反应,促进水解平衡右移,使Fe3+转化为Fe(OH)3被除去,而氧化铜不被损耗,且不会引入新杂质。
(2)电解硫酸铜溶液,化学方程式为:2CuSO4+2 H2O 2Cu+O2↑+2H2SO4.或Fe+CuSO4=Cu+FeSO4
2Cu+O2↑+2H2SO4.或Fe+CuSO4=Cu+FeSO4
(3)这一问应从工艺流程图的结构入手,通过(1)的分析,已经知道固体A为氢氧化铁,加入试剂a后得到的溶液通过反应v加入b,滤液中的溶质能转化为FeSO4,根据物质的转化原理可知b为Fe。
(4)获得绿矾晶体时先蒸发浓缩,因为硫酸铁的溶解度随温度的升高而增大,所以降温溶解度减小,会析出晶体,最后过滤即可.
(5)反应Ⅰ中的反应物是CuFeS2、O2、H2SO4三种物质,生成物是硫酸铁、硫酸铜和水,根据奇偶法配平,所以方程式是:4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;
本题难度:一般
4、选择题 (13分)某研究性学习小组的同学利用下图来验证某铜银合金完全溶解于浓硝酸时生成的气体除NO2外还含有NO,并测定合金中铜的质量分数。已知常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4晶体。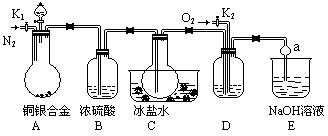
(1)写出A中铜与硝酸反应的一个化学方程式_________________________________
(2)反应前先打开A部分的活塞K1,持续通入一段时间的N2,理由是_________________
若装置中缺少B部分,会影响验证的结果,其原因是___________________________
(3)反应结束后,打开活塞K2,并通入O2,若有NO产生,则D产生的现象是________
_______________________
(4)实验测得的数据如下:合金质量15.0g,13.5mol/LHNO340mL;实验后A溶液:V=40mL,c(H+)=1.0mol/L,假设反应中硝酸无挥发也没有分解。则反应中消耗的HNO3物质的量为_____mol;
(5)利用A装置中反应后溶液也可确定铜的质量分数,方法是取出A中的反应的溶液,向其中加入足量的_____溶液,然后进行的操作的步骤分别是______________。
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)3+2NO2↑+2H2O或
3Cu+8HNO3(稀)=3Cu(NO3)3+4H2O+2NO↑
(2)排除装置中的空气,防止干扰验证性实验;部分NO2与水作用生成NO干扰验证性实验(3)有红棕色气体生成(4)0.5(5)盐酸(1分,其它合理也可以);过滤、洗涤、干燥、称量
本题解析:略
本题难度:简单
5、计算题 为了测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确量取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200 mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0 g;再另取同样的FeSO4溶液200 mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0 g。
(1)通过计算,填写下表:
| c(H+) | c(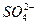 ) ) | c(Fe2+、Fe3+) |
| ? | ? | ? |
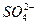 )的关系。
)的关系。参考答案:(1)0.1 mol·L-1? 0.6 mol·L-1? 0.5 mol·L-1
(2)40%?(3)c(Fe2+、Fe3+)=c(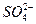 )-c(H+)
)-c(H+)
本题解析:(1)由pH=1得c(H+)="0.1" mol·L-1
由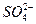 +Ba2+====BaSO4↓得
+Ba2+====BaSO4↓得
c(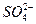 )=
)=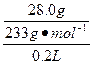 ="0.6" mol·L-1
="0.6" mol·L-1
因为最终固体物质为Fe2O3,
所以n(Fe2O3)=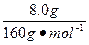 ="0.05" mol
="0.05" mol
据铁元素守恒得:
c(Fe2+、Fe3+)=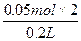 ="0.5" mol·L-1
="0.5" mol·L-1
(2)设FeSO4溶液中含Fe2+、Fe3+的物质的量分别为x、y,则: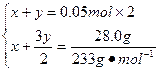
解得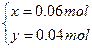
所以FeSO4溶液中Fe2+被氧化的百分率为: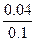 ×100%=40%
×100%=40%
(3)由(1)中c(H+)="0.1" mol·L-1
c(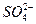 )="0.6" mol·L-1
)="0.6" mol·L-1
c(Fe2+、Fe3+)="0.5" mol·L-1
得c(Fe2+、Fe3+)=c(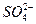 )-c(H+)。
)-c(H+)。
本题难度:简单