时间:2018-03-17 05:41:31
1、选择题 某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中各阳离子的浓度相同(不?考虑溶液中离子的变化),且SO42-的物质的量浓度为6mol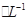 ,则此溶液最多能溶解铁粉的质量为
,则此溶液最多能溶解铁粉的质量为
A.5.6g
B.11.2 g
C.22.4g
D.33.6g
参考答案:C
本题解析:n(SO42-)=0.1L×6mol?L-1=0.6mol,CuSO4、Fe2(SO4)3、H2SO4的溶液中阳离子的浓度相同,则有n(Cu2+)=n(H+)=n(Fe3+),由于溶液中阳离子的浓度相同,所以阳离子物质的量也相同,设Cu2+、Fe3+、H+三种离子物质的量均为n,根据电荷守恒知道:2n+3n+n=0.6mol×2,由此解得n=0.2mol,Cu2+、H+、Fe3+都能与Fe反应生成Fe2+,最后溶液的成分为FeSO4,则n(FeSO4)=0.6mol,根据Fe的守恒可知,此溶液最多溶解铁粉的物质的量为0.6mol-0.2mol=0.4mol,则此溶液最多溶解铁粉的质量为0.4mol×56g/moL=22.4g,故选C
本题难度:一般
2、填空题 (14分)铜是第四周期重要的过渡元素之一,其单质及化合物具有广泛用途。
请回答下列有关问题:
⑴铜原子的基态电子排布式是? ▲?。比较第一电离能Cu? ▲?Zn(填 “>”、“=”、“<”),说明理由? ▲?。
⑵氮和铜形成某种化合物的晶胞结构如图所示,则其化学式为? ▲?。(每个球均表示1个原子)
⑶铜可以形成多种多样的配合物。
① NH3可以和很多过渡金属形成配合物。NH3分子中心原子的杂化类型为? ▲ 杂化,与NH3互为等电子体的粒子有? ▲?。(只写其中一种)
②向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。试用离子方程式表示其原因 ▲ 、 ▲? 。
⑷在绿色植物标本的制作过程中,将植物材料洗净后浸入5%的硫酸铜溶液中,叶绿素(如图1)中心离子Mg2+被置换成Cu2+(如图2),叶片则永保绿色,请在图2中用箭头表示出配位键。
参考答案:(14分)
(1)① 1s22s22p63s23p63d104s1或[Ar] 3d104s1(2分)? <(1分) Cu失去1个电子后内层电子达到全充满的稳定状态(1分)
(2) Cu3N(2分)
(3)① SP3 ?H3O+ (各1分)
②Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+(2分)
Cu(OH)2+4NH3=Cu(NH3)42++2OH-(2分)
(3)(2分)
本题解析:略
本题难度:简单
3、选择题 向铁和铜的混合物中加入一定量的稀硫酸,反应后剩余了m1克金属,再继续加入一定量的硝酸钠溶液后剩余了m2克金属,则m1和 m2的大小关系正确的是( ?)
A.m1=m2
B.m1>m2
C.m1 < m2
D.m1 ≥ m2
参考答案:D
本题解析:铁、铜混合物中加硫酸,铜与硫酸不反应。
若硫酸过量,则剩余固体为Cu,再向溶液中加硝酸钠固体,又发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,铜继续溶解,m1>m2;若硫酸恰好完全反应,剩余固体为Cu,溶质为FeSO4,再加硝酸钠溶液,Cu不溶解,m1=m2;
若硫酸少量,剩余固体为Fe和Cu,溶质为FeSO4,再加硝酸钠,Fe、Cu不溶解,m1=m2。3-的氧化性?分类讨论思想
点评:本题不能凭思维定势解题,要分类讨论,具体情况具体分析。
本题难度:一般
4、选择题 已知:Cu +2Fe3+ = Cu2+ + 2Fe2+ ,Fe + Cu2+ = Fe2+ + Cu.,在硫酸铁溶液中,加入ag铜,完全溶解后,又加入bg铁,充分反应后得到cg残余固体,且b<c,则下列判断正确的是
A.最后得到的溶液中不含有Fe3+
B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+
D.残余固体一定全部是铜
参考答案:AB
本题解析:由于b小于c,所以剩余的固体中一定含有铜,液可能含有铁,因此溶液中一定没有铁离子,所以选项AB正确,CD不正确,答案选AB。
本题难度:一般
5、填空题 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。以孔雀石为原料可制备CuSO4·5H2O及纳米材料G,步骤如下: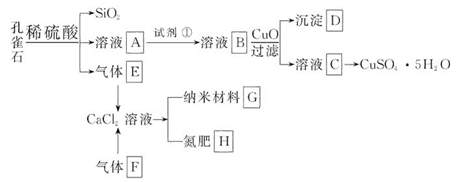
请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中,试剂①最佳为_______(填代号)。
a.KMnO4? b.(NH4)2S? c.H2O2? d.HNO3
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为______________。加入CuO的作用是_____________________。
(2)由溶液C获得CuSO4·5H2O,需要经过一系列操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是______________。
(3)制备纳米材料G时,应向CaCl2溶液中先通入(或先加入) _______ (填化学式)。写出该反应的化学方程式_______________________________________。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应用_______ (填写仪器名称);取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为_______。
参考答案:(1)c? Fe(OH)3?调节溶液的pH,促进Fe3+的水解
(2)引流
(3)NH3? 2NH3+CO2+H2O+CaCl2=CaCO3↓+2NH4Cl
(4)酸式滴定管(或移液管)
当滴入最后一滴KMnO4溶液时,溶液变成浅紫色且半分钟内颜色不变化
本题解析:根据题意可分析出该工业流程为: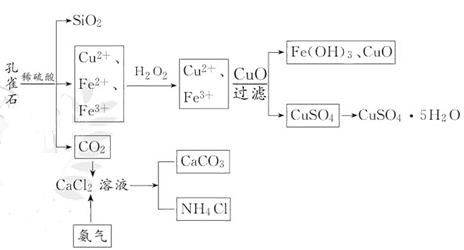
(1)要除去溶液A中的Fe2+,应把Fe2+氧化为Fe3+,试剂①应为绿色氧化剂H2O2,加CuO的目的是降低H+浓度,使Fe3+水解为Fe(OH)3而除去。
(2)过滤时应用玻璃棒引流。
(3)由气体E为CO2,且和CaCl2溶液和气体F反应生成纳米材料和NH4Cl可知纳米材料G应为CaCO3。气体E为CO2,与CaCl2不反应,应使CaCl2溶液呈碱性才能与CO2反应,由生成NH4Cl可知F气体应是NH3。
(4)KMnO4溶液具有强氧化性,只能用酸式滴定管盛放。KMnO4溶液呈紫红色,当KMnO4过量时显示浅紫色
本题难度:一般