时间:2017-11-11 04:21:09
1、选择题 等物质的量浓度的下列溶液中,NH4+离子的浓度最大的是
A.NH4Cl
B.NH4HCO3
C.NH3·H2O
D.NH4HSO4
2、选择题 氯化铵晶体溶于重水(D2O)中,溶液呈现酸性,下列叙述的原因中正确的是
A.NH4+水解生成NH3·H2O和HD2O+
B.NH4+水解生成NH3·DHO和HD2O+
C.NH4+水解生成NH3·D2O和HD2O+
D.NH4+水解生成NH3·DHO和D3O+
3、选择题 将等体积的0.1 mol·L-1 KHSO4溶液逐滴加入0.1 mol·L-1的Na2SO3溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中不正确的是
A.c(SO)>c(SO)>c(H+)>c(OH-)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=c(SO)+c(H2SO3)+c(HSO)+c(SO)
D.c(Na+)+c(K+)+c(H+)=2c(SO)+c(HSO)+c(OH-) +2c(SO)
4、填空题 室温下,0.1mol/L的醋酸溶液的PH约为3,当向其中加入醋酸钠晶体溶解后发现溶液的PH变大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大,因而溶液的PH增大;乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的PH增大。
(1)上述解释中 (填“甲”或“乙”)正确。
(2)为验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸中加入少量下列物质中的_____,然后测定溶液的PH值。
A.固体CH3COOK
B.固体CH3COONH4
C.NH3气体
D.固体NaHCO3
(3) 若_____(填“甲”或“乙”)的解释正确,溶液的PH应_____(填“增大”、“减小”或“不变”)
(4)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有 种粒子
②溶液中有两种粒子的物质的量之和一定等于0.01mol,它们是 和
③溶液中n(CH3COO-)+ n(OH-)-n(H+)=
5、填空题 (18分)研究SO2、NOx、CO等气体的性质对工业生产和环境保护具有重要意义。
(1)相同物质的量的SO2与NH3溶于水发生反应的离子方程式为________________,所得溶液中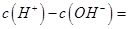 _________ (填字母编号)。
_________ (填字母编号)。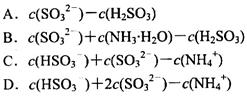
(2)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均Pt电极,电解质为熔融氧化物。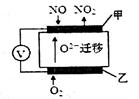
①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
(3)将不同物质的量的H2O(g)和 CO分别通入体积为2L的恒容密闭容器中,发生反应:H2O(g)+CO(g)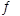 CO2(g)+H2(g) △H,得到如下数据:
CO2(g)+H2(g) △H,得到如下数据: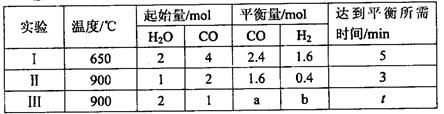
①由表中数据可知该反应的△H________ 0(填“>”或“<”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、lmol CO、1 mol CO2和2 molH2,则反应在开始时_________进行(填“正向”或“逆向”)。
③实验III中a=______,达平衡时实验II和实验III中H2O(g)的转化率的大小关系为: (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。