时间:2017-11-11 03:51:24
1、实验题 某同学对MnO2、CuO、Fe2 O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。 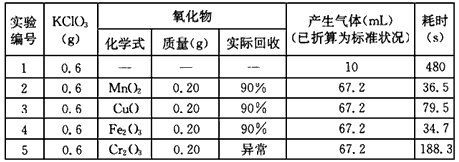
就本实验的有关问题,请填空:
(1)本实验的装置由下图三部分组成,其正确的接口连接顺序为__________ 。 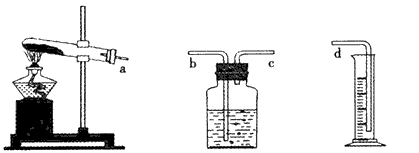
(2)为证明编号2的实验中MnO2起到催化作用,还要测定反应剩余物中MnO2 的质量,实验的操作顺序是:溶解→ _______________
(3)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为 ____________(填物质的化学式)。
(4)从编号3的实验数据,可计算出KClO3的分解率为_____________%(保留一位 小数)。
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是 ___________(填化学式),可用___________试纸检验该气体,上述异常现象产生的原因是______________。
(6)研究表明“在使用等质量催化剂时,增大催化剂比表面积(单位质量表面积) 可提高化学反应速率”。请设计验证此结论的实验方案: ________________。
参考答案:(1)a→c→b→d
(2)过滤→洗涤→干燥→称量
(3)Fe2O3、MnO2、CuO
(4)40.8
(5)Cl2? ;润湿的淀粉碘化钾 ;氯酸钾与Cr2O3发生氧化还原反应,生成氯气
(6)分别取两份等质量的氯酸钾和两份等质量但颗粒大小不一致的二氧化锰混匀后装入上述的装置进行实验,测量完全反应时所耗用的时间长短或是在同等时间内收集气体体积多少等
本题解析:
本题难度:困难
2、实验题 某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究。
(1)提出假设 ①气体产物是CO2。?②气体产物是CO。?③气体产物是__________。
(2)设计方案? 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。 
(3)查阅资料氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,该反应的离子方程式:_______________。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g; ?
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为_____________。
(5)数据处理试根据实验数据分析判断,前面的假设_________(填①、②、③)是正确的。写出该实验中氧化铁与碳发生反应的化学方程式:______________________。
参考答案:(1)CO2、CO的混合物?
(3)NH4++NO2- N2↑+2H2O
N2↑+2H2O
(4)步骤②中是为了排尽空气、步骤④是为了赶出所有的CO2,确保完全吸收 ?
(5)③;2C+Fe2O3 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
本题解析:
本题难度:一般
3、实验题 某班同学用如图所示的装置测定空气里氧气的含量。药匙上放少量钠,烧杯中装满水,先用弹簧夹夹住橡胶管。点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。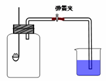
(1)写出燃烧匙中发生反应的化学方程式:?,将该生成物伸入瓶底的水中,生成的氧化产物与还原产物物质的量之比为:?。
(2)实验完毕,广口瓶内水面上升明显小于空气体积的1/5,对这一现象解释正确的是:?
a.该同学可能未塞紧瓶塞,导致钠熄灭时外界空气进入瓶内
b.该同学可能使用钠的量不足
c.该同学可能没夹紧弹簧夹,钠燃烧时部分空气受热从导管逸出
d.该同学可能插入燃烧匙太慢,塞紧瓶塞前瓶内部分空气受热逸出
参考答案:(1)2Na+O2 Na2O2;1:2?(2)ab
Na2O2;1:2?(2)ab
本题解析:该实验利用金属钠燃烧消耗集气瓶集气瓶内氧气,压强减小,回复室温后,打开弹簧夹,烧杯内的水进入集气瓶,水的体积就是消耗掉氧气的体积。金属钠燃烧反应生成Na2O2,2Na2O2+2H2O=4NaOH+O2,Na2O2既是氧化剂又是还原剂,氧化产物是氧气,NaOH有一半是还原产物,氧化产物与还原产物物质的量之比为1:2,最后水的体积小,说明所测结果体积偏小,a导致外界空气进入装置,倒流回去的水偏少,正确;b、钠不足,没有把氧气消耗完,所测体积少,正确;c、空气溢出,水倒流的应该更多,错误;d、空气溢出,水倒流的应该更多,错误。
本题难度:一般
4、实验题 (12分)用18 mol/L 的浓硫酸配制100 ml 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积?②量取一定体积的浓硫酸?③溶解?
④检漏 、转移、洗涤?⑤定容、摇匀
、转移、洗涤?⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是?,量取浓硫酸所用的量筒的规格是?(用下列编号填空)。
A.10ml
B.25ml
C.50ml
D.100ml)
(2)第③步实验的操作是?
?
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线?;改用?向容量瓶中滴加蒸馏水至?为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)检验试剂瓶中的溶液含有SO42-的操作是? ?
?
?
(5)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
①容量瓶用蒸馏水洗涤后残留有少量的水?;
②所用过的烧杯、玻璃棒未洗涤?;
③加水超过刻度线后,用胶头滴管吸出多余的液体?。
参考答案:(12分)(1)16.7mL? B?(2)(3)略 ⑷无影响,偏小,偏小
B?(2)(3)略 ⑷无影响,偏小,偏小
本题解析:略
本题难度:一般
5、实验题 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快。
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为?。
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10 mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 750C | 一 | 一 | 1mL | 100s |
| 2 | 750C | 10滴 | 一 | 1mL | 40s |
| 3 | 750C | 10滴 | 加入少许 | 1mL | 3s |
参考答案:I.(1)5H2C2O4+2MnO4?+6H+=2Mn2++10CO2↑+8H2O
(2)随着草酸溶液与高锰酸钾溶液反应的进行,生成了Mn2+,Mn2+作为该反应的催化剂,可以加快化学反应速率。
II.(1)②
③菠菜中还含有其他还原性物质,能与KMnO4反应
本题解析:I.(1)高锰酸钾溶液具有氧化性,能氧化草酸为二氧化碳,依据原子守恒和电荷守恒配平书写离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
(2)图表中高锰酸钾溶液加热,褪色时间较长,加入少许硫酸锰速率增大较快,反应需要的时间缩短,Mn2+起到催化作用,加入稀硫酸褪色时间缩短,说明生成的锰离子对分解起了催化作用。
II.(1)②依据反应的离子方程式计算,设草酸物质的量为x:
5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O
5? 2
x? 0.0100mol/L×v×10-3L
可得菠菜中草酸盐(以C2O42-计)的质量分数为
③用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液中可能含有其他还原性物质会消耗高锰酸钾,导致结果可能偏高。
本题难度:一般