时间:2017-11-11 03:31:59
1、填空题 (14分)质子交换膜燃料电池广受关注。
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+O2(g) CO(g) ΔH1=-110.35kJ·mol-1
CO(g) ΔH1=-110.35kJ·mol-1
2H2O(l) 2H2(g)+O2(g) ΔH2=+571.6kJ·mol-1
2H2(g)+O2(g) ΔH2=+571.6kJ·mol-1
H2O(l) H2O(g) ΔH3=+44.0kJ·mol-1
H2O(g) ΔH3=+44.0kJ·mol-1
则C(s)+H2O(g) CO(g)+H2(g) ΔH4= 。
CO(g)+H2(g) ΔH4= 。
(2)燃料气(流速为1800mL·h-1;体积分数为50% H2,0.98% CO,1.64% O2,47.38% N2)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。
①160 ℃、CuO/CeO2作催化剂时,CO优先氧化反应的化学方程式为 。
②灼烧草酸铈[ Ce2(C2O4)3]制得CeO2的化学方程式为 。
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示。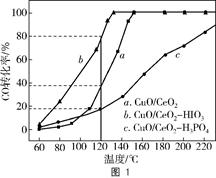
加入 (填酸的化学式)的CuO/CeO2催化剂催化性能最好。催化剂为CuO/CeO2—HIO3,120℃时,反应1h后CO的体积为 mL。
(3)图2为甲酸质子交换膜燃料电池的结构示意图。该装置中 (填“a”或“b”)为电池的负极,负极的电极反应式为 。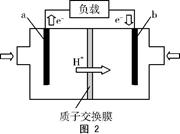
参考答案:(1) +131.45 kJ·mol-1
(2) ①2CO+O2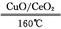 2CO2
2CO2
②Ce2(C2O4)3 2CeO2+4CO↑+2CO2↑
2CeO2+4CO↑+2CO2↑
③HIO3; 3.528
(3) a; HCOOH-2e- CO2↑+2H+
CO2↑+2H+
本题解析:(1)C(s)+O2(g) CO(g) ΔH1=-110.35kJ·mol-1 ①
CO(g) ΔH1=-110.35kJ·mol-1 ①
2H2O(l) 2H2(g)+O2(g) ΔH2=+571.6kJ·mol-1 ②
2H2(g)+O2(g) ΔH2=+571.6kJ·mol-1 ②
H2O(l) H2O(g) ΔH3=+44.0kJ·mol-1 ③
H2O(g) ΔH3=+44.0kJ·mol-1 ③
ΔH=ΔH1+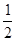 ΔH2-ΔH3="+131.45" kJ·mol-1
ΔH2-ΔH3="+131.45" kJ·mol-1
(2)①160 ℃、CuO/CeO2作催化剂时,CO优先氧化生成CO2,反应的化学方程式为2CO+O2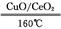 2CO2
2CO2
②灼烧草酸铈[ Ce2(C2O4)3]制得CeO2,CO2和CO,化学方程式为Ce2(C2O4)3 2CeO2+4CO↑+2CO2↑
2CeO2+4CO↑+2CO2↑
③在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度变化如图1所示。从图中可知,加入HIO3反应速度快,所需温度低,CO的转化率大;120℃时,CO的转化率为80%
反应1h后CO的体积为×1800×0.98%×80%=3.528mL;
(3)由图2可知,电子从a端进入,从b端流出,说明a为电池的负极;且电极反应为HCOOH-2e- CO2↑+2H+。
CO2↑+2H+。
考点:反应热的计算,化学反应方程式的书写,化学反应方程式的计算,原电池的相关知识
本题难度:困难
2、选择题 已知在25℃,101kPa下,l gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
[? ]
A.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g);△H=-48.40kJ·mol-1
B.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-5518kJ·mol-1
C.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=+5518kJ·mol-1
D.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1);△H=-48.40kJ·mol-1
参考答案:B
本题解析:
本题难度:一般
3、填空题 (15分)在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
⑵实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
A.酒精灯
B.长直玻璃导管
C.锥形瓶
D.直型冷凝管
E.尾接管(接液管) F.蒸馏烧瓶 G.滴定管
②除上述必需的仪器外,还缺少的主要玻璃仪器是 。
⑶肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为 g。
⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. 。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是 。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生 现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。
参考答案:⑴N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH1=-64a kJ·mol-1 ; ⑵ ①BG;②温度计;⑶8g
⑷假设3:黑色粉末是CuO和Fe3O4的混合物 ;①溶液显蓝色 ; ②“2或3”; ③红色固体;
④红褐色沉淀 ;红褐色沉淀,同时溶液呈深蓝色
本题解析:⑴根据题意可得反应的热化学方程式为N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH1=-64a kJ/mol;(2)①在蒸馏过程中需要的仪器是酒精灯、蒸馏烧瓶、温度计、直型冷凝管、尾接管(接液管)、锥形瓶。所以不需要的玻璃仪器是长直玻璃导管、滴定管。因此选项为BG。②除上述必需的仪器外,还缺少的主要玻璃仪器是温度计;⑶肼与Fe2O3反应的方程式是N2H4+6Fe2O3= 4Fe3O4+ N2+2H2O。根据方程式可知,若生成1molFe3O4,需要消耗肼0.25mol,它的质量为0.25mol×32g/mol=8g。⑷根据给出的假设情况可推知假设3是黑色粉末是CuO和Fe3O4的混合物 ;取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。 ①若假设1成立,则实验现象是溶液显蓝色;②若所得溶液显血红色,则假设“2或3”成立;③为进一步探究,继续向所得溶液加入足量铁粉,若产生红色固体则假设3成立。 ④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生红褐色氢氧化铁沉淀 ;若产生的现象是既有红褐色沉淀,同时溶液呈深蓝色,则假设3成立。
考点:考查热化学方程式的书写、仪器的选择与使用、实验方案的设计、验证、氧化反应反应方程式的书写及相应的计算的知识。
本题难度:困难
4、简答题 如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有______.(填字母)
a.减少化石燃料的使用,开发新能源?b.使用无氟冰箱,减少氟利昂排放
c.多步行或乘公交车,少用专车或私家车?d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料.一定条件下由CO和H2生产甲醇的化学方程式为______.该反应合成l?molCH3OH(1)放出热量131.9kJ,又知2H2(g)+CO(g)+
| 3 2 |

参考答案:(1)a.大量化石燃料的燃烧是二氧化碳的主要来源,减少化石燃料的使用,开发新能源,有利于降低大气中的CO2、SO2、NO2浓度,故a正确;
b.氟里昂能促进臭氧地方分解,与大气中的CO2、SO2、NO2浓度无关,故b错误;
c.汽车尾气中有多种有害物质,主要污染物是一氧化碳、碳氢化合物、氮的氧化物和烟尘等,故多步行或乘公交车,少用专车或私家车有利于降低大气中的CO2、SO2、NO2浓度,故c正确;
d.将工业废气用碱液吸收后再排放能减少CO2、SO2、NO2的排放,故d正确.
故答案为:acd;?
(2)CO和H2反应生成甲醇,反应方程式为:CO+2H2=CH3OH;
根据液态甲醇燃烧生成二氧化碳和水蒸气,化学方程式为:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g),
已知:①CO+2H2=CH3OH△H1=+131.9kJ?mol-1
②2H2(g)+CO(g)+32O2(g)=CO2(g)+2H2O(g)△H2=-594.1kJ?mol-1
根据盖斯定律,2×(②-①)得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)故△H=2×(△H2-△H1)=-1452kJ?mol-1,
故热化学方程式为:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1452kJ?mol-1,
故答案为:CO+2H2=CH3OH;2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1452kJ?mol-1;?
(3)①由图可知,温度越高SO3的含量越低,即升高温度平衡向逆反应移动,所以正反应是放热反应,△H<0,
故答案为:<;
②该反应是一个放热反应,升高温度,平衡向逆反应方向移动,所以生成物的浓度减小,反应物的浓度增大,平衡常数减小,所以K1>K2;D状态相对于A状态,三氧化硫的含量较小,要使该反应达到平衡状态,该反应必须向正反应方向移动,所以正反应速率大于逆反应速率.
故答案为:>;>.
本题解析:
本题难度:一般
5、填空题 A、D、E、X、Y是原子序数依次增大的短周期元素。其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素在考古方面有重要应用。
(1)Y的简单离子的结构示意图为___。
(2)钠、A和X三种元素组成的化合物,其所含的化学键类型有____。
(3)甲由A、E两种元素组成,分子中含有18个电子,只存在单键。常温下甲是一种无色液体同时也是一种二元弱碱, 写出其在水中的电离方程式:___ 。
(4)处理含DX、YX2烟道气污染的一种方法是在催化剂作用下使两者反应,产物之一为单质Y。已知反应生成1gY 固体单质时放出8.4 kJ的热量,此反应的热化学方程式为___。
参考答案:(2)离子键、共价键
(3)N2H4 +H2O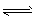 N2H5+ +OH- 、N2H5+ +H2O
N2H5+ +OH- 、N2H5+ +H2O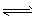 N2H62++OH -
N2H62++OH -
(4)2CO(g)+SO2(g)==2CO2(g)+S(s) △H=-268. 8 kJ . mol -1
本题解析:
本题难度:一般