时间:2017-11-11 03:31:59
1、选择题 12g石墨在24g的氧气中燃烧至反应完全,测得放出xkJ的热量,已知石墨的燃烧热为y kJ·mol-1。则石墨与氧气反应生成CO的热化学方程式正确的是
[? ]
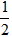 O2(g)=CO(g) △H=-ykJ·mol-1
O2(g)=CO(g) △H=-ykJ·mol-1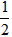 O2(g)=CO(g) △H=-(2x-y)kJ·mol-1
O2(g)=CO(g) △H=-(2x-y)kJ·mol-12、选择题 氢气和氟气混合在黑暗处即可发生爆炸而释放出大量的热量。在反应过程中,断裂1molH2中的化学键消耗的能量为Q1kJ,断裂1molF2中的化学键消耗的能量为Q2kJ,形成1molHF中的化学键释放的能量为Q3kJ。下列关系式中正确的是
A.Q1+ Q2<2Q3
B.Q1+ Q2>2Q3
C.Q1+ Q2<Q3
D.Q1+ Q2>Q3
3、填空题 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态过氧化氢(H2O2)。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
又知H2O(l)=H2O(g) ΔH=+44kJ/mol。
(1)写出过氧化氢(H2O2)的结构式 。
(2)液态肼与液态过氧化氢反应生成液态水反应的热化学方程式为 。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______ 。
4、选择题 下列中和反应热化学方程式可用:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1来表示的是( ? )
A.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H=-Q1?kJ?mol-1
B.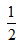 H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-Q2?kJ?mol-1
H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H=-Q2?kJ?mol-1
C.HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);△H=-Q3?kJ?mol-1
D.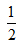 H2SO4?(aq)+
H2SO4?(aq)+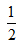 Ba(OH)2(aq)=
Ba(OH)2(aq)=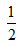 BaSO4?(s)+H2O(l);△H=-Q4?kJ?mol-1
BaSO4?(s)+H2O(l);△H=-Q4?kJ?mol-1
5、填空题 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。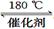
(1)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为:2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下:
NO NO2
NO2 N2
N2
已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O = NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)利用CO催化还原氮氧化物也可以达到消除污染的目的。
已知质量一定时,增大固体催化剂的表面积可提高化学反应速率。如图是反应2NO(g) + 2CO(g) 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、等质量催化剂表面积(S)和时间(t)的变化曲线。据此判断该反应的△H 0 (填“>”、“<”或“无法确定”);催化剂表面积S1 S2 (填“>”、“<”或“无法确定”)。