时间:2017-11-11 03:28:59
1、填空题 25 ℃时,0.1 mol·L-1的醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)上述两种解释中__________(填“甲”或“乙”)正确。
(2)为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的_______(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4 C.气体NH3 D.固体NaHCO3
(3)若__________(填“甲”或“乙”)的解释正确,溶液的pH应__________(填“增大”“减小”或“不变”)。(已知25 ℃时,CH3COONH4溶液呈中性)
(4)常温下,将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液。判断:
①溶液中共有__________种粒子。
②其中有两种粒子的物质的量之和一定等于0.010 mol,它们是__________和__________。
③溶液中n(CH3COO-)+n(OH-)-n(H+)=__________mol。
2、选择题 已知酸H2B在水溶液中存在下列关系:①H2B H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
A.NaHB属于弱电解质
B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-]
C.[Na+]=[HB-]+[B2-]+[H2B]
D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O
3、选择题 今有两种盐的稀溶液,分别是a mol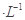 NaX溶液和b mol
NaX溶液和b mol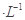 NaY溶液,下列说法不正确的是(? )。
NaY溶液,下列说法不正确的是(? )。
A.若a=b,pH(NaX)>pH (NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)="c" (Y-)+c(HY);则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时, 酸性HX<HY
D.若两溶液等体积混合,测得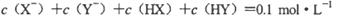
则可推出a+b=0.2 mol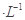
4、选择题 已知HA和HB都是弱酸,且常温下相同浓度的两种酸溶液中,HA溶液中的氢氧根的浓度大于HB溶液。下列叙述不正确的是
A.0.1 mol?L—1HA溶液中:c(H+)— c(OH-)=c(A-)
B.将pH=3的HB与pH=11的氢氧化钠溶液等体积混合后所得溶液显酸性
C.0.2 mol·L-1HB溶液与0.1 mol·L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(B—)-c(HB)?
D.物质的量浓度均为0.01mol?L—1的NaA和NaB的混合溶液中:c(OH—)> c(HB)> c(HA)>c(H+)
5、选择题 下列反应中,属于水解反应且使溶液显酸性的是
A.CH3COOH+OH- CH3COO-+H2O
CH3COO-+H2O
B.HCO3—+ H2O  CO32- + H3O+
CO32- + H3O+
C.S2- + H2O HS-+ OH-
HS-+ OH-
D.NH4+ + H2O  NH3·H2O + H+
NH3·H2O + H+