时间:2017-11-11 03:17:59
1、简答题 在①HF、②H2S、③BF3、④CS2、⑤CCl4、⑥N2、⑦SO2分子中:
(1)以非极性键结合的非极性分子是______
(2)以极性键相结合,具有直线型结构的非极性分子是______
(3)以极性键相结合,具有正四面体结构的非极性分子是______
(4)以极性键相结合,而且分子极性最大的是______.
2、选择题 下列各分子中,所有原子都满足最外层为8电子结构的是
A.H2O
B.BF3
C.CCl4
D.PCl5
3、简答题 如图所示是前四周期的五种元素在周期表中的相对位置关系.乙和丁的原子序数之和为甲的4倍,则
(1)用电子式表示丁的气态氢化物的形成过程为:______;
(2)乙、丁按原子个数比1:3组成的化合物电子式为(各原子最外层均达到8e-稳定结构)______;
(3)丙的气态氢化物的结构式为______;
(4)戊的原子序数为______;在元素周期表中的位置为第______周期______族;
(5)原子半径大小关系为:丁______戊;(简单)离子半径大小关系为:丙______丁;
(6)乙、丙、丁的最高价氧化物水化物中,不属于强酸的是______(填化学式);
(7)甲和丙形成的某化合物A可以使下列溶液褪色:①溴水②品红溶液③高锰酸钾酸性溶液④滴有酚酞的氢氧化钠溶液,其中A表现漂白性的是______(填序号).
4、选择题 A、B、C均为短周期元素,它们在周期表中的位置如图所示.已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍.则A、B、C分别是( )
A.C、A.l、P
B.N、Si、S
C.0、P、Cl
D.F、S、Ar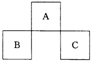
5、填空题 a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)写出下列粒子的电子式: ①c__________;②d__________;③e__________;④a__________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:__________>__________(用化学式表示)。
(3)用电子式表示b元素与氧形成的化合物b2O的形成过程:_______________________________。