时间:2017-11-11 02:48:41
1、选择题 在25 ℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阳极逸出
amol气体,同时有Wg Na2SO4·10H2O析出,若温度不变,此时剩余溶液中溶质的质量分数为
[? ]
A. ×100%
×100%
B.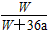 ×100%
×100%
C.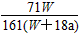 ×100%
×100%
D. ×100%
×100%
参考答案:D
本题解析:
本题难度:一般
2、计算题 浓硫酸与铜在加热时反应,生成二氧化硫气体的体积为2.24 L(标准状况)。试计算:
(1)被还原的硫酸的物质的量。
(2)若将生成的硫酸铜配制成500 mL溶液,则该溶液中溶质的物质的量浓度是多少?
参考答案:(l)n(H2SO4)被还原=0.1mol
(2)0.2 mol/L
本题解析:
本题难度:一般
3、选择题 如图为反应Fe+CuSO4═Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示( )
A.Fe,S
B.Cu,S
C.Fe,O
D.Fe,Cu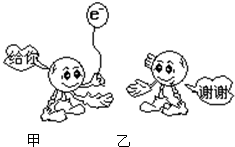
参考答案:D
本题解析:
本题难度:简单
4、选择题 下列说法正确的是
A.物质所含元素化合价升高的反应叫还原反应
B.阳离子只有氧化性,阴离子只有还原性
C.失电子多的还原剂,还原性强
D.物质中某元素得到电子,则此物质是氧化剂
参考答案:D
本题解析:
本题难度:一般
5、计算题 如图所示,通电5min后,第③极增重2.16g,同时在A池中收集到标准状况下的气体224mL,设A池中原混合液的体积为200mL,求通电前A池中原混合溶液Cu2+的浓度。
参考答案:解:在A池中发生的反应为:
阳极(②极):4OH--4e-=2H2O+O2↑
阴极(①极):2Cu2++4e-=2Cu
若Cu2+完全放电后还有:4H++4e-=2H2↑
转移电子的物质的量为:2.16÷108=0.02(mol)
由电极反应可知,每转移4mol电子,放出1molO2,所以②极上析出O2的体积为:
0.02÷4×22.4=0.112(L)<0.224(L)
说明A池收集到的气体中还有H2。
①极上放出H2为:0.224-0.112=0.112(L),即0.005mol。
①极上析出Cu和放出H2共获得0.02mol电子。
Cu2+的物质的量为:(0.02-0.005×2)/2=0.005(mol)
[Cu2+]=0.005/0.2=0.025mol/L
答:通电前A池中原混合溶液Cu2+的浓度为0.025mol/L。
本题解析:
本题难度:一般