时间:2017-11-11 02:27:24
1、简答题 实验题:
某化学兴趣小组做了如下三个实验:
实验A:集气瓶中放青色、未熟的水果(蔬菜),盖上玻璃片;
实验B:集气瓶中放青色、未熟的水果(蔬菜),通入一定量的乙烯;
实验C:集气瓶中放青色、未熟的水果(蔬菜),瓶底放少量KMnO4固体,盖上玻璃片.
请根据所学化学知识完成下列问题:
(1)预期实验结果:水果成熟的先后顺序是______(用序号填写)
(2)解释你的预期结果的原因______.
为探究?Na、Mg、Al的金属活动性顺序,某课外小组同学进行了如下实验:
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中; 2将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3将一小段镁带投入稀盐酸中; 4将一小片铝投入稀盐酸中. 实验现象 A剧烈反应,迅速生成大量的气体 B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C反应不剧烈,产生无色气体 D有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 实验现象 |
2、推断题 现有A、B、C、D、E、F六种常见的短周期主族元素,原子序数依次递增,原子半径A<D<C<B<F<E,B、C、D、E、F的简单离子的电子数为10,且原子的最外层电子数的关系为A+D=B+F=8;已知HNO2为弱酸,NaNO2具有下列性质: 2NO2-+2I-+4H+=2NO+I2+2H2O;2MnO4-+5NO2+6H+=2Mn2++5NO3-+3H2O请回答:
(1)B与E可形成离子化合物E3B,试写出它的电子式:_______________。
(2)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,其化学反应方程式:_____________________。
(3)在常温下,A、B、C三种元素形成的两种常见PH均为5的强电解质溶液G和H,且水电离出的氢离子浓度比值为最大,则G、H的化学式分别为___________、___________G和H溶液中由水电离出的氢离子浓度比值为_________________。
(4)①已知A、B、C三种元素组成的一种离子化合物B2A4C2,其溶液显酸性,原因为________________________。(用文字说明原因)
②A、B、C三种元素组成的另一种离子化合物B2A4C3,其水溶液也显酸性,设计一个实验方案鉴别以上两种离子化合物___________________。
3、选择题 砹是核电荷数最大的卤族元素,推测砹及其化合物最不可能具有的性质是
A.HAt很不稳定
B.砹是白色固体
C.AgAt不溶于水
D.砹易溶于某些有机溶剂
4、推断题 有原子序数不大于18,原子序数依次递增的A,B,C,D 4种元素,A,C两种元素的电子层数相同,A和C形成化合物AC,D和A形成化合物AD,9gB与足量的稀盐酸反应,可生成标准状况下的11.2 L H2,且向所得溶液中加入NaOH,可观察到先有沉淀生成,继续加入NaOH,沉淀溶解。
(1)写出这4种元素的名称和符号。_______________________
(2)写出这4种元素最高价氧化物对应水化物的化学式,分析其酸碱性的变化情况。
_________________________
5、选择题 现有4种短周期元素的有关信息如下表所示:则甲、乙、丙、丁四种元素的原子序数从大大小排列的是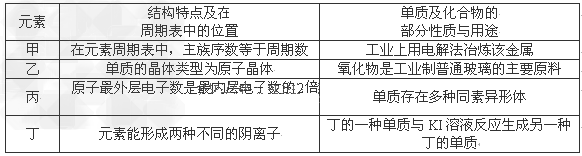
[? ]
A.甲、乙、丙、丁
B.丁、甲、乙、丙
C.丙、丁、甲、乙
D.乙、甲、丁、丙