时间:2017-11-11 02:27:24
1、选择题 短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。则下列有关说法中正确的是
A.X的氢化物溶于水显酸性
B.Z的氧化物的水化物一定是强酸
C.Y的氧化物是离子化合物
D.X和Z的最高价氧化物对应的水化物都是弱酸
2、推断题 有关元素X、Y、Z、W的信息如下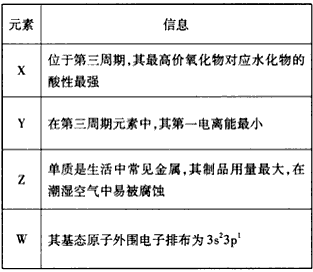
请回答下列问题:
(1)Y的单质在空气中充分燃烧所得氧化物的电子式为____________
(2)X、Y、W的简单离子的半径由大到小的顺序是_________(写离子符号)
(3)向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为________________________,基态Z3+的电子排布式为___________
(4)以WX3溶液为原料制取无水WX3,主要操作包括加热浓缩、冷却结晶、过滤,先制得WX3·6H2O晶体,然后在________条件下加热WX3·6H2O晶体,能进一步制取无水WX3,其原因是(结合离子方程式简要说明)___________________。
3、简答题 针对下面10种元素,完成以下各小题.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 2 C N O Ne 3 Na Mg Al Si S Cl |
4、推断题 A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和。
(1)写元素符号:A为_________,B为_________,C为_________。D的最高价氧化物的水化物化学式是
_________。
(2)写出A、B形成的化合物与E反应的化学方程式:___________________________。
(3)E属_________(“离子”或“共价”)化合物。E中含_________键.
(4)C与D两元素可形成化合物,用电子式表示其化合物的形成过程___________________________。
5、选择题 下列关于碱金属及其化合物的叙述正确的是( )
A.熔沸点从锂到铯逐渐降低
B.随核外电子层数递增,单质密度依次增大
C.Li在氧气中燃烧生成Li2O2
D.碳酸铯受热易分解