时间:2017-11-11 02:25:07
1、填空题 (8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸? Ka= 1.75×10-5
碳酸? Ka1= 4.30×10-7? Ka2 = 5.61×10-11
亚硫酸? Ka1= 1.54×10-2? Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = ??;
碳酸的第一步电离比第二步电离?(填“容易” 或 “困难”)。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱:??>?>?
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是?(填序号)
A.c(CH3COO-)
B.c(H+)
C.醋酸的电离平衡常数
D.醋酸的电离度
参考答案:(1) ?容易?(2)H2CO3 > HSO3- > HCO3-?(3) A D
?容易?(2)H2CO3 > HSO3- > HCO3-?(3) A D
本题解析:(1)碳酸的第一步电离方程式为H2CO3 H++HCO3-,所以电离平衡常数表达式为Ka1 =
H++HCO3-,所以电离平衡常数表达式为Ka1 =  。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
(2)酸电离平衡常数越大,说明酸越强。所以根据电离平衡常数可知,H2CO3、HCO3-和HSO3-的酸性强弱顺序为H2CO3 > HSO3- > HCO3-。
(3)加入乙酸,增大氢离子浓度,抑制醋酸的电离,所以选项AD减小,B增大,C不变。
本题难度:一般
2、选择题 常温下,将少量水加入下列物质中,相关量变化正确的是( )
A.AgCl悬浊液中?c(Cl-)变小
B.0.1mol/LCH3COOH溶液中?c(H+)变小
C.0.1mol/LNa2CO3?c(HCO3-)变大
D.0.1mol/LNH4Cl溶液中?n(OH-)变小
参考答案:A、悬浊液是饱和的,加入少量水之后仍是饱和的,所以向氯化银悬浊液中加入少量水能促进氯化银的电离,但氯离子浓度均不变,故A错误.
B、CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,但由于溶液体积增大的倍数大于电离的倍数,导致溶液的pH增大,导电能力减弱,溶液中C(H+)减小,故B正确.
C、碳酸钠溶液加水稀释,越稀越水解,水解程度增大了,n(HCO3-)变大,溶液体积也增大了,且增大的比n(HCO3-)增大得多,所以?c(HCO3-)变小,故C错误.
D、氯化铵溶液中加水稀释,能促进氯化铵的水解,导致氢离子物质的量增大,溶液的体积也增大,但溶液体积比氢离子物质的量增大的多,所以氢离子浓度变小,则氢氧根离子浓度增大,溶液的体积增大,导致氢氧根离子的物质的量也增大,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 下列事实能说明亚硝酸是弱电解质的是
[? ]
①亚硝酸钠溶液的PH大于7 ②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1mol·L-1HNO2溶液的PH=2.1
A.①②③
B.②③④
C.①④
D.①②④
参考答案:C
本题解析:
本题难度:简单
4、选择题 氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
[? ]
A.再通入少量氯气,c(H+)/c(ClO-)减小
B.通入少量SO2,溶液漂白性增强
C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.加入少量水,水的电离平衡向正反应方向移动
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列过程表达式中,属于电离方程式的是
A.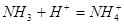
B.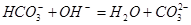
C.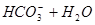
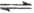
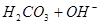
D.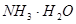
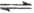
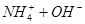
参考答案:D
本题解析:A、B是离子间发生化学反应不是电离,C是水解,D是电离。
考点:常见化学方程式发生的反应的类别。
本题难度:一般