时间:2017-11-11 02:14:40
1、选择题 下列物质反应后一定没有+3价铁元素的是(?)
A.过量的铁丝在氯气中点燃
B.Fe(NO3)2溶液中加少量盐酸
C.铁与氧化铁的混合物溶于盐酸中
D.过量的铁与稀硝酸反应
参考答案:D
本题解析:铁和氯气反应生成物总是氯化铁;在酸性条件下,NO3-能把Fe2+氧化生成Fe3+;C中如果氧化铁过量,则会生成铁离子;D中铁是过量的,所以生成物是硝酸亚铁,答案选D。
点评:该题是基础性试题的考查,试题侧重考查学生灵活运用基础性知识解决实际问题的能力,难度不大。该题的关键是学生熟练掌握铁的化学性质,然后灵活运用即可。
本题难度:一般
2、实验题 (6分)Fe3O4一种黑色粉末,又称磁性氧化铁,它的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
▲提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. ______________________________。
▲设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
⑴若假设1成立,则实验现象是________________。
⑵若所得溶液显血红色,则假设_________成立。
⑶为进一步探究,继续向所得溶液加入足量铁粉,若产生_______的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
⑷为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若产生__________现象,则假设2成立;若产生______________现象,则假设3成立。
参考答案:(6分)(1,1,1,1,1,1)
假设3:黑色粉末是CuO和Fe3O4的混合物
⑴溶液显蓝色?
⑵2或3?
⑶有红色固体析出
⑷红褐色沉淀?红褐色沉淀,同时溶液呈深蓝色
本题解析:略
本题难度:一般
3、实验题 (8分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用在空气中向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到整个过程的实验现象是______________,②加入NaOH溶液后,反应过程中发生反应的化学方程式是______________________和__________________。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有Fe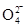 )。
)。
Ⅱ.SCN-的电子式为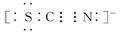
Ⅲ.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为Fe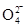 ,请写出该离子反应方程式________________________。
,请写出该离子反应方程式________________________。
②第二种假设是:__________________________。
参考答案:(8分)(1)①产生白色沉淀,迅速变为灰绿色,最终变成红褐色
②FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)①2Fe3++3Cl2+8H2O===2Fe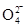 +6Cl-+16H+
+6Cl-+16H+
②SCN-被Cl2氧化 (方程式2分,其余每空1分)
本题解析:(1)由于生成的氢氧化亚铁极易被空气氧化生成氢氧化铁,所以实验现象是首先产生白色沉淀,然后迅速变为灰绿色,最终变成红褐色。有关反应的方程式是FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3。
(2)①在反应铁元素的化合价从+3价升高到+6价,失去3个电子,而氯气只能得到2个电子,所以根据电子的得失守恒可知,反应的方程式是2Fe3++3Cl2+8H2O===2Fe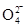 +6Cl-+16H+。
+6Cl-+16H+。
②根据SCN-的电子式可知,S和N元素的化合价分别是-2价和-3价,易被氯气氧化,因此红色也可以褪去。
本题难度:一般
4、选择题 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如右图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为
A.2∶1∶4
B.1∶2∶4
C.1∶2∶1
D.1∶1∶4
参考答案:D
本题解析:根据强者优先规则,氧化性强的要先与铁粉反应。
反应顺序为:Fe+4HNO3=Fe(NO3)3+NO+4H2O,此反应消耗1molFe,故有4molHNO3反应,同时生成1molFe(NO3)3。
2Fe(NO3)3+Fe=3Fe(NO3)2,此反应消耗1molFe,故有2molFe(NO3)3反应,但上一步生成了1molFe(NO3)3,故稀溶液中的Fe(NO3)3为1mol。
Cu(NO3)2+Fe=Fe(NO3)2+Cu,该反应消耗1molFe,故有1molCu(NO3)2反应。
同一溶液体系中,各物质的物质的量浓度之比等于物质的量之比,故稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为1∶1∶4
故选D
本题难度:一般
5、计算题 (6分)、0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量是多少摩尔?
参考答案:0.16mol
本题解析:溶液中铁离子和铜离子的物质的量分别都是0.24mol。由于铜离子的氧化性弱于铁离子的,所以首先是铁离子氧化单质铁,方程式为2Fe3++Fe=3Fe2+;
如果铁离子完全反应,则生成亚铁离子是0.36mol,此时溶液中Fe2+与Cu2+物质的量之比为3︰2,这说明溶液中铁单质也和铜离子反应,方程式为Fe+Cu2+=Fe2++Cu。
设和铜离子反应的单质铁是x,则消耗铜离子是x,生成亚铁离子是x,所以有(x+0.36mol)/(0.24mol-x)=2,解得x=0.04mol,
所以加入的铁粉是0.12mol+0.04mol=0.16mol
本题难度:一般