时间:2017-11-11 02:14:40
1、简答题 复印机使用的墨粉主要成份是Fe3O4,如图是氧化沉淀法生产Fe3O4的工艺: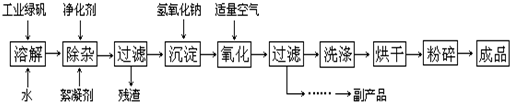
已知:①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
②Fe(OH)2+2Fe(OH)3→Fe3O4?4H2O
请回答下列问题:
(1)铁的常见氧化物有______;
(2)Fe3O4与盐酸反应的化学方程式是:______,检验反应后的溶液中含Fe3+的方法:______;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:______;
(4)生产中可获得的副产品是______,提取该副产品的操作顺序是:______(填写序号)
a.过滤?b.加热浓缩?c.冷却?d.结晶?e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16kg/h,为使产品较纯,鼓入空气的速率应为______m3/h(假设反应在标准状态下进行,空气中O2占20%).
参考答案:(1)铁有三种常见的氧化物:FeO、Fe2O3、Fe3O4,故答案为:FeO、Fe2O3、Fe3O4?
(2)解此类型题,一是看清题中提供的有效信息,认真分析整合根据化合价写出反应物、生成物的化学式;二是遵循质量守恒定律写出相关的化学方程式,注意配平,配平时,遵循式子两边各元素的原子个数相等的原则反应的方程式为
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,Fe3+与硫氰化钾溶液反应,使溶液变红色,所以检验是否含Fe3+离子的方法为:取少量待测液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+.
(3)Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3
(4)氢氧化钠和硫酸亚铁溶液反应后生成氢氧化亚铁和硫酸钠,所以副产品是硫酸钠,由硫酸钠溶液变为失去结晶水的硫酸钠的过程为:加热浓缩,冷却,结晶,过滤,洗涤.故答案为:Na2SO4?10H2O(或芒硝,写Na2SO4也可);bcdae;
(5)鼓入的空气应恰好与FeSO4完全反应,12.16 kg工业绿矾中含FeSO4的物质的量:12160g×52.5%152g/mol=42mol
设鼓入空气的速率应为Vm3/h
根据:6 FeSO4∽O2∽2 Fe3O4
? 6mol? 22.4L
? 42mol? Vm3×103L/m3×1/5
解得:V=0.784
故答案为:0.784
本题解析:
本题难度:一般
2、选择题 Cu、Cu2O和CuO组成的混合物加入100 mL 0.6 mol/L HNO3溶液,恰好使混合物溶解,同时收集到224 mL NO气体(标准状况)。下列说法不正确的是
A.产物中硝酸铜的物质的量为0.025 mol
B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol
C.若混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量均为0.005 mol
D.混合物中Cu的物质的量的取值范围为0.005 mol<n(Cu)<0.015 mol
参考答案:B
本题解析:本题考查化学计算,意在考查考生的分析能力。根据氮元素守恒可知硝酸铜的物质的量为(0.1 L×0.6 mol/L- ?÷2)=0.025 mol,故A正确。若混合物中Cu的物质的量为0.005 mol,设Cu2O和CuO的物质的量分别为x mol、y mol,则0.005+2x+y=0.025(铜元素守恒),0.005×2+2x=0.01×3(电子守恒),解得x=0.01,y=0,故B错误。同理可得C正确。设混合物中Cu的物质的量为z mol,则z+2x+y=0.025,2z+2x=0.03,两式相减得z=y+0.005,据此有z>0.005;又由2z+2x=0.03推得z=0.015-x,据此有z<0.015,故有0.015>z>0.005,故D正确。
?÷2)=0.025 mol,故A正确。若混合物中Cu的物质的量为0.005 mol,设Cu2O和CuO的物质的量分别为x mol、y mol,则0.005+2x+y=0.025(铜元素守恒),0.005×2+2x=0.01×3(电子守恒),解得x=0.01,y=0,故B错误。同理可得C正确。设混合物中Cu的物质的量为z mol,则z+2x+y=0.025,2z+2x=0.03,两式相减得z=y+0.005,据此有z>0.005;又由2z+2x=0.03推得z=0.015-x,据此有z<0.015,故有0.015>z>0.005,故D正确。
本题难度:一般
3、填空题 (16分)将6.4 g铜加入到50 mL a mol/L的硝酸溶液中,铜全部溶解,得到NO2和NO的混合气体。将反应后溶液稀释至100 mL,测得NO3-的浓度为3 mol/L。试求:
(1)在铜与浓硝酸反应中,硝酸表现出 ;
A.酸性
B.氧化性
C.酸性和氧化性
D.还原性
(2)铜与稀硝酸反应的离子方程式为 ;
(3)反应中生成硝酸铜的物质的量是  mol;
mol;
(4)混合气体中NO2和NO的总物质的量为 m ol(用含a的式子表示);
ol(用含a的式子表示);
(5)稀释后的溶液中H+的物质的量浓度为 mol/L;
(6)若a=9,则混合气体中NO2的质量为 g;
(7)用NaOH溶液吸收产生的混合气体,原理为:
2NO2+2NaOH=NaNO2+NaNO3+H2O; NO2+NO+2NaOH= 2NaNO2+H2O
2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,则a的取值范围为 。
参考答案:(其中第7小题4分,其余第小题2分,共16分)
(1)C; (2)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O; (3)0.1;(4)0.05a-0.3; (5) 1; (6)5.75; (7)8≤a<10
1; (6)5.75; (7)8≤a<10
本题解析:略
本题难度:简单
4、选择题 下列叙述I和II均正确并且有因果关系的是
| 选项 | 陈述I | 陈述II |
| A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
| B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
| D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃瓶中 参考答案:D 本题解析:NH4Cl为强酸弱碱盐的原因是HCl是强酸、NH3?H2O是弱碱,用加热法除去NaCl中的NH4Cl的原因是NH4Cl受热易分解为氨气来源:91考试网 91eXAm.org、氯化氢气体,而NaCl的热稳定性很强,则陈述I、II均正确,但是它们没有因果关系,A项错误;Fe3+具有氧化性的原因是铁元素的化合价可以从+3价将为+2价甚至0价,用KSCN溶液可以鉴别Fe3+的原因是Fe3+遇KSCN溶液迅速显红色,则陈述I、II均正确,但是它们没有因果关系,B项错误;向碳酸钙悬浊液中通入过量二氧化碳气体可得澄清溶液,说明碳酸钙是难溶于水的钙盐,碳酸氢钙是易溶于水的钙盐,则溶解度:CaCO3<Ca(HCO3)2,向饱和碳酸钠溶液中通入二氧化碳气体析出碳酸氢钠晶体,说明碳酸钠是易溶于水的钠盐,碳酸氢钠是可溶于水的钠盐,则溶解度:Na2CO3>NaHCO3,则陈述I正确,陈述II错误,C项错误;由二氧化硅的性质可知,HF是唯一能腐蚀或溶解SiO2的酸,则陈述I、II正确并且有因果关系,D项正确。 本题难度:一般 5、填空题 如图,盛有足量水的水槽里放两个烧杯,小烧杯里放有少量铜片和过量浓硝酸,小烧杯外面倒扣一个大烧杯,请回答: 参考答案:(1)Cu+4HNO3==Cu(NO3)2 +2NO↑+2H2O 本题解析: 本题难度:一般 |