时间:2017-11-11 01:42:30
1、选择题 下列性质适合于离子晶体的是
A.熔点1070 ℃,易溶于水,水溶液能导电
B.熔点10.31 ℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
D.熔点97.81 ℃,质软,导电,密度0.97 g·cm-3
2、填空题 结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
(1)下列4种物质熔点沸点由高到低排列为______________(填序号)
①金刚石(C—C)? ②晶体硅(Si—Si)? ③金刚砂(Si—C)
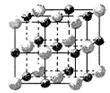
(2)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个
顶点,该晶体中 X、Y、Z的粒子个数比为______________;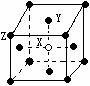
(3)按所示格式填写下表有序号的表格:
| 原子序数 | 原子价层电子排布 | 周期 | 族 |
| 17 | ① | 第三 | ② |
| ③ | 3d54s1 | ④ | ⅥB |
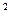 2s
2s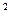 2p
2p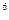 3s
3s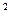 3p
3p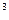 4s
4s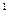 ,则该元素基态原子的电子排布式为 ?;其最高价氧化物对应的水化物的化学式是?。
,则该元素基态原子的电子排布式为 ?;其最高价氧化物对应的水化物的化学式是?。3、填空题 决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
4、填空题 下表为长式周期表的一部分,其中的编号代表对应的元素。 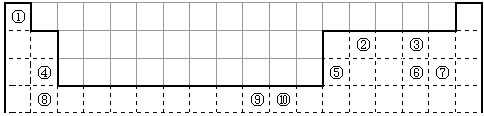
请回答下列问题
(1)表中属于d区的元素是________________(填编号)。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为_________________(用对应的元素符号表示)。 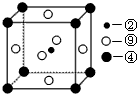
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是__________________。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.该氢化物分子中,②原子采用sp2杂化
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为_________;该元素与元素①形成的分子X构形为______________;X在①与③形成的分子Y中的溶解度很大,其主要原因是__________________________。
(5)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:__________________ 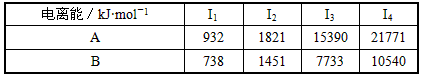
(6)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或
d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+
_____________颜色(填“无”或“有”)。
5、填空题 (1)+3价Co的配合物CoClm·nNH3,中心原子的配位数为6,若1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,用配合物形式写出该配合物的化学式?。
(2)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大磁记录性能越好。离子型氧化物MnO2和Fe3O4及Cr2O3中,磁性最大的是___________。
(3)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如下左图),每个碳原子通过 ? 杂化与周围碳原子成键。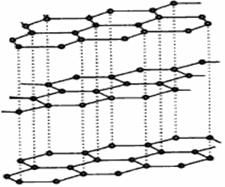 ?
? ?
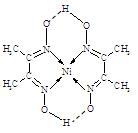
?
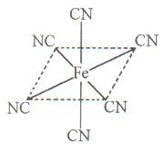
(4)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如上右图。
①已知CN—与N2结构相似,1molCN-中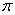 键数目为?。
键数目为?。
②上述沉淀溶解过程的化学方程式为?。