时间:2017-11-11 01:40:57
1、推断题 短周期元素Q、R、T、W在元素周期表中的位置如下图所示,期中T所处的周期序数与主族序数相等,请回答下列问题: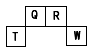
(1)元素的非金属性为(原子的得电子能力):Q ____W(填“强于”或“弱于”)。
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____________________________________。
(3)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是_______。
2、选择题 原子核外每个电子层上均含有2n2个电子的元素是
A.Be
B.C
C.Ar
D.Ne
3、选择题 下列递变规律对碱金属和卤素都能适用的是
A.从上到下,单质熔沸点逐渐升高
B.从上到下,单质硬度逐渐增大
C.从上到下,单质密度逐渐增大
D.从上到下,最高价氧化物对应水化物的酸性逐渐增强
4、填空题 下图是我们熟悉的元素周期表,请回答下列问题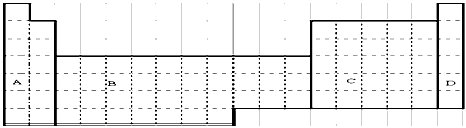
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)在上面元素周期表中全部是金属元素的区域为_____________(填序号)。
A.A? B.B? C.C? D.D
(3)①写出表示含有8个质子、10个中子的原子的化学符号:______________。
②周期表中位于第8纵行的铁元素属于第______________族。
③周期表中最活泼的非金属元素位于第______________纵行。
④所含元素超过18种的周期是第______、______周期。
(4)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的________族。
5、简答题 下表是元素周期表的一部分.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA 1 ① | 2 ② ③ ④ ⑤ ⑥ 3 ⑦ ⑧ ⑨ ⑩ | |||||