时间:2017-11-11 01:10:43
1、填空题 根据以下信息回答下列问题。
Ⅰ .盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
.盐碱地(含较多NaCl、Na2CO3)不利于作物生成,通过施加适量石膏(CaSO4)可以降低土壤的碱性。
Ⅱ.长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用盐酸除去。
①请用离子方程式表示盐碱地产生碱性的原因:?;
②请用化学方程式表示 加入石膏降低土壤碱性的反应原理?;
加入石膏降低土壤碱性的反应原理?;
③请写出水垢悬浊液中CaSO4溶解平衡的离子方程式?;
④ 请分析水垢中的CaSO4转化为CaCO3的原理?;
请分析水垢中的CaSO4转化为CaCO3的原理?;
⑤请写出CaCO3溶于过量盐酸的离子方程式?。
参考答案:①CO32-+H2O  ?HCO3-+OH-, HCO3-+H2O
?HCO3-+OH-, HCO3-+H2O H2CO3+OH-
H2CO3+OH-
②CaSO4+Na2CO3=CaCO3+ Na2SO4
③ CaSO4(s)  Ca2+(aq)+SO42-(aq)
Ca2+(aq)+SO42-(aq)
④CaSO4的沉淀溶解平衡,加入Na2CO3溶液后,CO32- 与Ca2+结合生成更难溶于水的CaCO3沉淀,Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动,CaSO4沉淀减少,CaCO3沉淀生成。
⑤CaCO3 +2H+= CO2↑+ H2O +Ca2+
本题解析:略
本题难度:简单
2、选择题 下列说法中正确的是
A.物质的溶解性为难溶,则该物质不溶于水
B.不溶于水的物质溶解度为0
C.某离子被沉淀完全是指该离子在溶液中的浓度为0
D.绝对不溶解的物质是不存在的
参考答案:D
本题解析:A、物质的溶解性为难溶,说明常温下溶解度小于0.01g,不是不溶于水,A错误;B、绝对不溶解的物质是不存在的,只是溶解度比较小而已,B错误;C、某离子被沉淀完全是指该离子在溶液中离子浓度小于1×10-5mol/L,浓度不是等于0,C错误;D、没有绝对不溶于水的物质,所以绝对不溶解的物质是不存在的,D正确;答案选D。
考点:考查溶解度、饱和溶液的概念。
本题难度:一般
3、选择题 下列说法中正确的是
[? ]
A.某离子被沉淀完全是指该离子在溶液中的浓度等于0
B.同一周期中的第ⅡA族和第ⅢA族元素的原子序数之差一定为1或11
C.原电池中负极材料本身不一定参与电极反应
D.水的离子积常数Kw随外加酸(碱)浓度的改变而改变
参考答案:C
本题解析:
本题难度:简单
4、填空题 物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。
请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_______________。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示):
__________________;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因:________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________________________,目的
是________________________;若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为____________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s)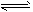 Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10 25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL
Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp = 1.8×10-10 25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL
0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是___________________(填写序号);②中氯离子的浓度
为____________mol·L-1。
参考答案:(1)c(NH4+) > c(SO42-) > c(H+) >c(OH-)?
(2)HCO3-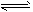 H++CO32-、HCO3+H2O
H++CO32-、HCO3+H2O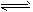 H2CO3+OH-、H2O
H2CO3+OH-、H2O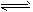 H++OH-;HCO3-的水解程度大于其电离程度,溶液中c(OH-) > c(H+),故溶液显碱性
H++OH-;HCO3-的水解程度大于其电离程度,溶液中c(OH-) > c(H+),故溶液显碱性
(3)盐酸;抑制Fe3+水解;Fe3++3HCO3-== Fe(OH)3↓+3CO2↑
(4)②①④③;9×10-10
本题解析:
本题难度:一般
5、选择题 常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列判断错误的是( )
A.a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L
D.向d点溶液中加入适量CaCl2固体可以变到c点
参考答案:A.处于曲线上的点为饱和溶液的平衡状态,故A正确;
B.a、c两点温度相同,Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故B错误;
C.根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,此时溶液中c(SO4-)会小于4×l0-3mol/L,由于c(Ca2+)>c(SO42-),则c(SO4-)小于3×l0-3mol/L,故C错误;
D.d点为不饱和状态,钙离子浓度较小,如加入适量CaCl2固体,钙离子浓度增大,此时硫酸根离子浓度不变,则可以变到c点,故D正确.
故选BC.
本题解析:
本题难度:一般